12,6 A escala de pH
Objectivos de aprendizagem
- Definir pH.
- Determinar o pH de soluções ácidas e básicas.
Como vimos, e os valores podem ser marcadamente diferentes de uma solução aquosa para outra. Assim, os químicos definiram uma nova escala que indica sucintamente as concentrações de um destes dois iões.
pH O logaritmo negativo da concentração de iões de hidrogénio. é uma função logarítmica de :
pH = -log
pH está normalmente (mas nem sempre) entre 0 e 14. Sabendo a dependência do pH de , podemos resumir da seguinte forma:
- se pH < 7, então a solução é ácida.
- se pH = 7, então a solução é neutra.
- Se pH > 7, então a solução é básica.
Esta é conhecida como a escala de pHA gama de valores de 0 a 14 que descreve a acidez ou basicidade de uma solução. Pode utilizar pH para fazer uma determinação rápida se uma dada solução aquosa é ácida, básica ou neutra.
Exemplo 12
Etiqueta cada solução como ácida, básica ou neutra com base apenas no pH indicado.
- leite de magnésia, pH = 10.5
- água pura, pH = 7
- vinho, pH = 3,0
Solução
- Com um pH superior a 7, o leite de magnésia é básico. (O leite de magnésia é em grande parte Mg(OH)2.)
- água pura, com um pH de 7, é neutro.
- Com um pH inferior a 7, o vinho é ácido.
- Sangue humano, pH = 7,4
- amónio doméstico, pH = 11.0
- glicose, pH = 3,6
- básico
- básico
- ácido
Teste-te a ti mesmo
Identificar cada substância como ácida, básica, ou neutra com base apenas no pH indicado.
Respostas
Quadro 12.3 “Valores típicos de pH de Várias Substâncias*” dá os valores típicos de pH de algumas substâncias comuns. Note-se que vários artigos alimentares estão na lista, e a maioria deles são ácidos.
Tabela 12.3 Valores típicos de pH de Várias Substâncias*
| Substance | pH |
|---|---|
| stomach acid | 1.7 |
| 2.2 | |
| 2.9 | |
| 3.0 | |
| 3.5 | |
| café, preto | 5.0 |
| 6.9 | |
| 7.0 | |
| sangue | 7.4 |
| 12.5 | |
| 14,0 | |
| *Os valores reais podem variar dependendo das condições. | |
p>pH é uma escala logarítmica. Uma solução com um pH de 1,0 tem 10 vezes o como solução com um pH de 2,0, que por sua vez tem 10 vezes o como solução com um pH de 3,0 e assim por diante.
= 10-pH
P>É preciso determinar como avaliar a expressão acima na sua calculadora. Pergunte ao seu instrutor se tiver alguma dúvida. A outra questão que nos preocupa aqui são números significativos. Uma vez que o(s) número(s) antes do ponto decimal num logaritmo se relacionam com a potência em 10, o número de dígitos após o ponto decimal é o que determina o número de números significativos na resposta final:
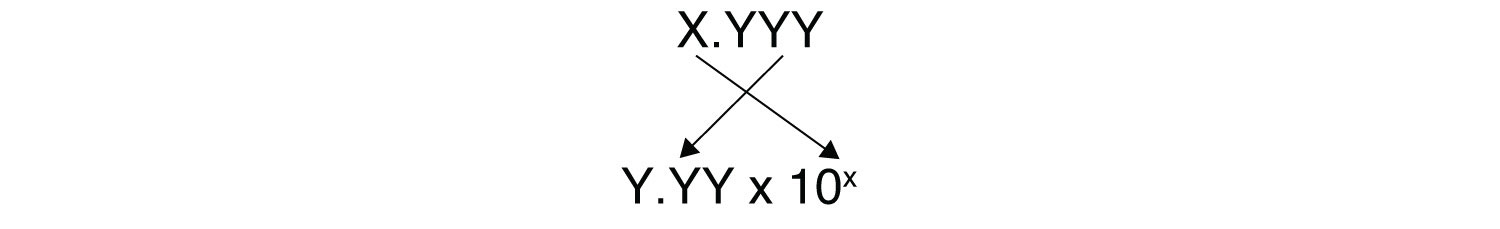
Existe uma forma mais fácil de relacionar e . Podemos também definir pOHO logaritmo negativo da concentração de iões de hidróxido. semelhante a pH:
pOH = -log
(De facto, p “qualquer coisa” é definido como o logaritmo negativo dessa qualquer coisa.) Isto também implica que
= 10-pOH
Uma relação simples e útil é que para qualquer solução aquosa,
pH + pOH = 14
Esta relação torna simples determinar o pH a partir de pOH ou pOH a partir do pH e depois calcular a concentração de iões resultante.
Key Takeaways
- pH é uma função logarítmica de .
- pode ser calculada directamente a partir de pH.
- pOH está relacionado com o pH e pode ser facilmente calculado a partir de pH.