12.6 La escala de pH
Objetivos de aprendizaje
- Definir el pH.
- Determinar el pH de las soluciones ácidas y básicas.
Como hemos visto, y los valores pueden ser notablemente diferentes de una solución acuosa a otra. Así que los químicos definieron una nueva escala que indica sucintamente las concentraciones de cualquiera de estos dos iones.
El logaritmo negativo de la concentración de iones hidrógeno. es una función logarítmica de :
PH = -log
El pH suele estar (aunque no siempre) entre 0 y 14. Conociendo la dependencia del pH de , podemos resumirlo de la siguiente manera:
- Si el pH < 7, entonces la solución es ácida.
- Si el pH = 7, entonces la solución es neutra.
- Si el pH > 7, entonces la solución es básica.
- Leche de magnesia, pH = 10.5
- Agua pura, pH = 7
- Vino, pH = 3,0
- Con un pH superior a 7, la leche de magnesia es básica. (La leche de magnesia es en gran parte Mg(OH)2.)
- El agua pura, con un pH de 7, es neutra.
- Con un pH inferior a 7, el vino es ácido.
- Sangre humana, pH = 7,4
- Amonio doméstico, pH = 11.0
- Cerezas, pH = 3,6
- básico
- básico
- ácido
- El pH es una función logarítmica de .
- puede calcularse directamente a partir del pH.
- El pOH está relacionado con el pH y puede calcularse fácilmente a partir del pH.
- .
Esto se conoce como la escala de pHEl rango de valores de 0 a 14 que describe la acidez o basicidad de una solución.. Puedes utilizar el pH para determinar rápidamente si una determinada solución acuosa es ácida, básica o neutra.
Ejemplo 12
Etiqueta cada solución como ácida, básica o neutra basándote únicamente en el pH indicado.
Solución
Ponte a prueba
Identifica cada sustancia como ácida, básica o neutra basándote únicamente en el pH indicado.
Respuestas
La tabla 12.3 «Valores típicos de pH de varias sustancias*» ofrece los valores típicos de pH de algunas sustancias comunes. Tenga en cuenta que varios alimentos están en la lista, y la mayoría de ellos son ácidos.
Tabla 12.3 Valores típicos de pH de varias sustancias*
| Sustancia | pH |
|---|---|
| ácido estomacal | 1.7 |
| zumo de limón | 2,2 |
| vinagre | 2.9 |
| soda | 3,0 |
| vino | 3,5 |
| café negro | 5.0 |
| leche | 6,9 |
| agua pura | 7,0 |
| sangre | 7.4 |
| agua de mar | 8,5 |
| leche de magnesia | 10,5 |
| solución de amoníaco | 12.5 |
| 1,0 M de NaOH | 14,0 |
| *Los valores reales pueden variar según las condiciones. | |
El pH es una escala logarítmica. Una solución que tiene un pH de 1,0 tiene 10 veces el como una solución con un pH de 2,0, que a su vez tiene 10 veces el como una solución con un pH de 3,0 y así sucesivamente.
= 10-pH
Debes determinar cómo evaluar la expresión anterior en tu calculadora. Pregunta a tu instructor si tienes alguna duda. La otra cuestión que nos preocupa aquí son las cifras significativas. Debido a que el número(s) antes del punto decimal en un logaritmo se relaciona con la potencia en 10, el número de dígitos después del punto decimal es lo que determina el número de cifras significativas en la respuesta final:
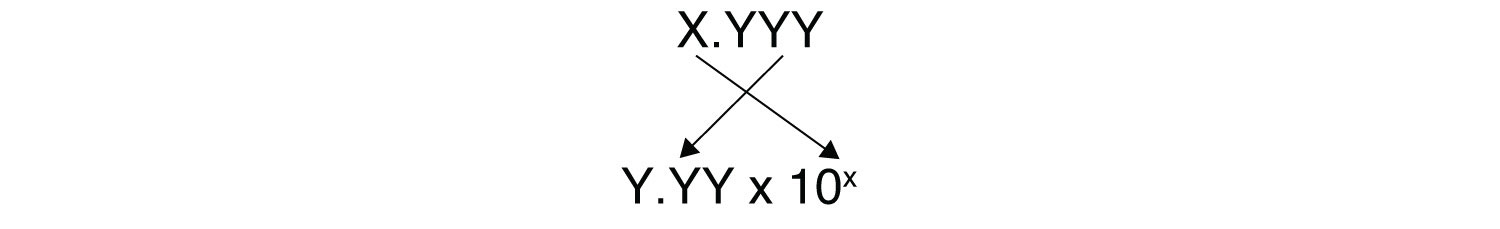
Hay una manera más fácil de relacionar y . También podemos definir pOHEl logaritmo negativo de la concentración de iones hidróxido. similar al pH:
pOH = -log
(De hecho, p «cualquier cosa» se define como el logaritmo negativo de esa cualquier cosa.) Esto también implica que
= 10-pOH
Una relación sencilla y útil es que para cualquier disolución acuosa,
pH + pOH = 14
Esta relación hace que sea sencillo determinar el pH a partir de pOH o pOH a partir de pH y luego calcular la concentración de iones resultante.