Fórmulas Moleculares
Fórmulas Moleculares dão o tipo e número de átomos de cada elemento presente no composto molecular. Em muitos casos, a fórmula molecular é a mesma que a fórmula empírica. A fórmula química será sempre um múltiplo inteiro (n) da fórmula empírica (ou seja, múltiplos inteiros dos subscritos da fórmula empírica).
p>>p> antes
p>>>p> O múltiplo inteiro, n, também pode ser obtido dividindo a massa molar, \(MM), do composto pela massa da fórmula empírica, \(EFM) (a massa molar representada pela fórmula empírica).
\\
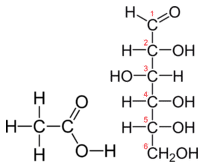
Tábua \(\PageIndex{1}}) mostra a comparação entre a fórmula empírica e molecular do metano, ácido acético e glucose, e os diferentes valores de n. A fórmula molecular do metano é {CH_4}} e porque contém apenas um átomo de carbono, que é também a sua fórmula empírica. Contudo, por vezes, a fórmula molecular é um simples número inteiro múltiplo da fórmula empírica. O ácido acético é um ácido orgânico que é o principal componente do vinagre. A sua fórmula molecular é {C_2H_4O_2}). A glicose é um açúcar simples que as células utilizam como fonte primária de energia. A sua fórmula molecular é a seguinte: {C_6H_6H_12}O_6}). As estruturas de ambas as moléculas são mostradas na figura {PageIndex{2}). São compostos muito diferentes, mas ambos têm a mesma fórmula empírica de \ce{CH_2O}}.
| Nome do Composto | Fórmula Molecular | Fórmula Empírica | n |
|---|---|---|---|
| Methane | (\ce{CH_4}\) | \(\ce{CH_4}\) | 1 |
| Ácido acético | \(\ce{C_2H_4O_2}) | 2 | |
| Glucose | \(\ce{C_6H_{12}O_6}\) |
p>Fórmulas empíricas podem ser determinadas a partir da composição percentual de um composto, tal como discutido na secção 6.8. A fim de determinar a sua fórmula molecular, é necessário conhecer a massa molar do composto. Os químicos utilizam um instrumento chamado espectrómetro de massa para determinar a massa molar dos compostos. Para passar da fórmula empírica à fórmula molecular, seguir estes passos:
- Calcular a massa molar de fórmula empírica (EFM).
- Divide a massa molar do composto pela massa molar de fórmula empírica. O resultado deve ser um número inteiro ou muito próximo de um número inteiro.
li>Multiplicar todos os subscritos da fórmula empírica pelo número inteiro encontrado no passo 2. O resultado é a fórmula molecular.
Exemplo \(\PageIndex{1})
p>p>A fórmula empírica de um composto de boro e hidrogénio é \ce{BH_3}). A sua massa molar é de 27,7: texto (g/mol). Determinar a fórmula molecular do composto.
Solução
| Steps for Problem Solving | |
|---|---|
| Identificar a informação “dada” e o que o problema lhe está a pedir para “encontrar”.” |
Div: p>Fórmula molecular \(= {BH_3})p>Massa solar \(= 27,7 \: \texto{g/mol})p>Fórmula molecular \(= ?\) |
| Calcular a massa da fórmula empírica (EFM). | \ |
|
\ |
|
| Multiplicar todos os subscritos na fórmula empírica pelo número inteiro encontrado no passo 2. O resultado é a fórmula molecular. |
\ |
| A fórmula molecular do composto é \(\ce{B_2H_6}\). | |
| A massa molar da fórmula molecular corresponde à massa molar do composto. |
Exercicio \(\PageIndex{1})
p>Vitamina C (ácido ascórbico) contém 40,92 % C, 4,58 % H, e 54,50 % O, em massa. A massa molecular, determinada experimentalmente, é 176 amu. Quais são as fórmulas empíricas e químicas para o ácido ascórbico? Resposta Fórmula Empírica C3H4O3 Resposta Fórmula Molecular C6H8O6