Formule molecolari
Le formule molecolari danno il tipo e il numero di atomi di ogni elemento presente nel composto molecolare. In molti casi, la formula molecolare è la stessa della formula empirica. La formula chimica sarà sempre un multiplo intero (\(n\)) della formula empirica (cioè multipli interi dei pedici della formula empirica).
pertanto
Il multiplo intero, n, può anche essere ottenuto dividendo la massa molare, \(MM\), del composto per la massa della formula empirica, \(EFM\) (la massa molare rappresentata dalla formula empirica).
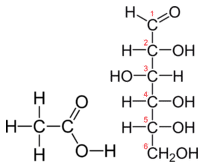
La tabella \(\PageIndex{1}\ mostra il confronto tra la formula empirica e molecolare di metano, acido acetico e glucosio, e i diversi valori di n. La formula molecolare del metano è \ce{CH_4}} e poiché contiene un solo atomo di carbonio, questa è anche la sua formula empirica. A volte, tuttavia, la formula molecolare è un semplice numero intero multiplo della formula empirica. L’acido acetico è un acido organico che è il componente principale dell’aceto. La sua formula molecolare è \ce{C_2H_4O_2}. Il glucosio è uno zucchero semplice che le cellule usano come fonte primaria di energia. La sua formula molecolare è \ce(\ce{C_6H_{12}O_6}). Le strutture di entrambe le molecole sono mostrate nella figura (\PageIndex{2}). Sono composti molto diversi, eppure entrambi hanno la stessa formula empirica di \ce{CH_2O}.
| Nome del composto | Formula molecolare | Formula empirica | n | |
|---|---|---|---|---|
| Metano | (\ce{CH_4}) | (\ce{CH_4}) | 1 | |
| Acido acetico | (\ce{C_2H_4O_2}) | (\ce{CH_2O}) | 2 | |
| Glucosio | (\ce{C_6H_{12}O_6}) | (\ce{CH_2O}) | (\ce{CH_2O}) | 6 |
Le formule empiriche possono essere determinate dalla composizione percentuale di un composto come discusso nella sezione 6.8. Per determinare la sua formula molecolare, è necessario conoscere la massa molare del composto. I chimici usano uno strumento chiamato spettrometro di massa per determinare la massa molare dei composti. Per passare dalla formula empirica alla formula molecolare, segui questi passi:
- Calcolare la massa molare della formula empirica (EFM).
- Dividere la massa molare del composto per la massa molare della formula empirica. Il risultato dovrebbe essere un numero intero o molto vicino a un numero intero.
- Moltiplica tutti i pedici nella formula empirica per il numero intero trovato al punto 2. Il risultato è la formula molecolare.
Esempio \(\PageIndex{1})
La formula empirica di un composto di boro e idrogeno è \(\ce{BH_3}\. La sua massa molare è \(27,7 \testo{g/mol}}. Determina la formula molecolare del composto.
Soluzione
| Steps for Problem Solving | Determina la formula molecolare di \(\ce{BH_3}\). |
|---|---|
| Identifica le informazioni “date” e ciò che il problema ti chiede di “trovare”.” |
Data: Formula empirica \(= \ce{BH_3}}) Massa molare \(= 27,7 \: \text{g/mol}) Trova: Formula molecolare \(= ? |
| Calcolare la massa della formula empirica (EFM). | |
| Dividere la massa molare del composto per la massa della formula empirica. Il risultato dovrebbe essere un numero intero o molto vicino a un numero intero. |
|
| Moltiplica tutti i pedici della formula empirica per il numero intero trovato al punto 2. Il risultato è la formula molecolare. |
\p> |
| Scrivi la formula molecolare. | La formula molecolare del composto è \(\ce{B_2H_6}\). |
| Pensa al tuo risultato. | La massa molare della formula molecolare corrisponde alla massa molare del composto. |
Esercizio \(\PageIndex{1})
La vitamina C (acido ascorbico) contiene il 40,92% di C, il 4,58% di H e il 54,50% di O, in massa. La massa molecolare determinata sperimentalmente è 176 amu. Quali sono le formule empiriche e chimiche dell’acido ascorbico?
Risposta Formula empirica C3H4O3 Risposta Formula molecolare C6H8O6