Cada orbital é assinalado por um número e uma letra.
O número denota o nível de energia do electrão no orbital. Assim, 1 refere-se ao nível de energia mais próximo do núcleo; 2 refere-se ao próximo nível de energia mais distante, e assim por diante.
A letra refere-se à forma do orbital. As letras vão na ordem s, p, d, f, g, h, i, j, etc. As letras s, p, d, e f foram atribuídas por razões históricas que não precisam de nos preocupar. Tudo o que temos de fazer é recordar as formas que correspondem a cada letra.
Desde que um electrão possa teoricamente ocupar todo o espaço, é impossível desenhar um orbital. Tudo o que podemos fazer é desenhar uma forma que incluirá o electrão a maior parte do tempo, digamos 95% do tempo. Chamamos a esta forma o contorno de 95%.
s ORBITALS
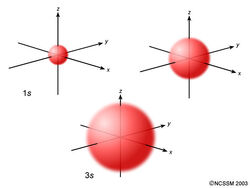
Um s orbital é esférico simétrico em torno do núcleo do átomo, como uma bola oca feita de material bastante fofo com o núcleo no seu centro. À medida que os níveis de energia aumentam, os electrões estão localizados mais longe do núcleo, pelo que os orbitais ficam maiores. A ordem de tamanho é 1s < 2s < 3s < …, como se mostra abaixo.
Agora, vejamos uma secção transversal destas orbitais.

Se olhar cuidadosamente, notará que um orbital de 1s tem muito pouca densidade de electrões perto do núcleo, mas que se acumula ao máximo à medida que se afasta do núcleo e depois diminui para além do contorno. É como uma bola de ténis oca.
A orbital 2s é semelhante a uma orbital 1s, mas tem uma esfera de densidade de electrões dentro da esfera exterior, como uma bola de ténis dentro de outra. Há uma superfície entre as duas bolas onde há zero probabilidades de encontrar um electrão. Chamamos a esta superfície um nó ou uma superfície nodal.
A 3s orbital é ainda maior, e tem três nós.
p ORBITALS
p>Nem todos os electrões habitam s orbitais. No primeiro nível de energia, o único orbital disponível para os electrões é o orbital 1s. Contudo, no segundo nível, existem também orbitais chamados orbitais 2p, além do orbital 2s.
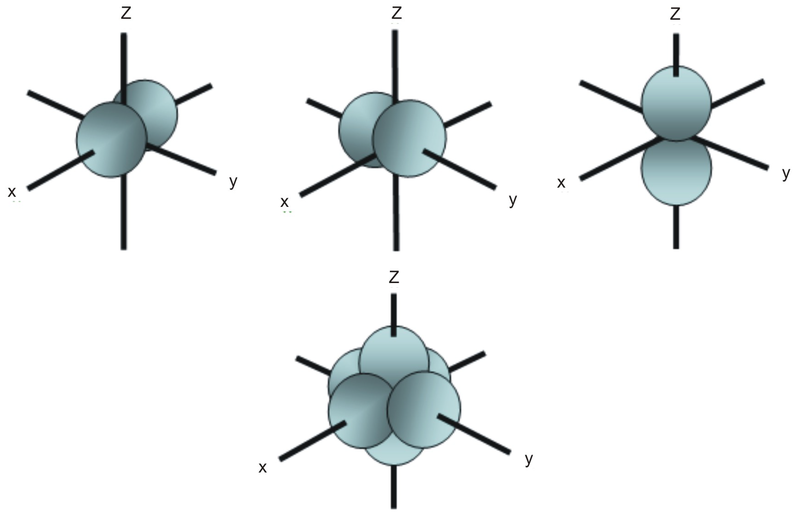
Não como um orbital s, um orbital p aponta numa determinada direcção. O mostrado abaixo aponta para cima e para baixo na página.

Em qualquer nível de energia, temos três orbitais p absolutamente equivalentes apontando mutuamente em ângulos rectos um para o outro. Estes são arbitrariamente dados os símbolos px, py e pz. Isto é simplesmente por conveniência, porque o que se poderia pensar como a direcção x, y ou z muda constantemente à medida que o átomo cai no espaço.
As orbitais p ao segundo nível de energia são chamadas 2px, 2py e 2pz. Existem orbitais semelhantes nos níveis subsequentes: 3px, 3px, 3pz, 4px, 4px, 4pz e assim por diante.
Todos os níveis, excepto o primeiro, têm orbitais p.
d ORBITAIS
Além de s e p orbitais, há dois outros conjuntos de orbitais que se tornam disponíveis para os electrões habitarem a níveis de energia mais elevados. No terceiro nível, existe um conjunto de cinco orbitais d (com formas e nomes complicados), bem como os orbitais 3s e 3p (3px, 3py, 3pz). No terceiro nível, há um total de nove orbitais no total.
p> Os cinco orbitais 3d são chamados
3dxy
3dxz
3ddyz
3dx² – y²
3dz²

Para dar sentido aos nomes, precisamos de olhar para eles em dois grupos. O primeiro grupo contém os orbitais 3dxy, 3dxz e 3dyz. Os nomes dizem-lhe que estas orbitais se encontram no plano x-y, no plano x-z, e no plano y-z, respectivamente. Cada orbital tem quatro lóbulos, e cada um dos lóbulos aponta entre dois dos eixos, não ao longo deles.
O segundo grupo contém os orbitais 3dx² – y² e 3dz². Os seus lóbulos apontam ao longo dos vários eixos.
O orbital 3dx² – y² parece exactamente igual ao primeiro grupo, excepto que os lóbulos estão a apontar ao longo dos eixos x e y, não entre eles.
O 3dz² parece um orbital p usando um donut à volta da sua cintura.
f ORBITALS
No quarto e mais alto nível, há sete f orbitais além dos 4s, 4p, e 4d orbitais.
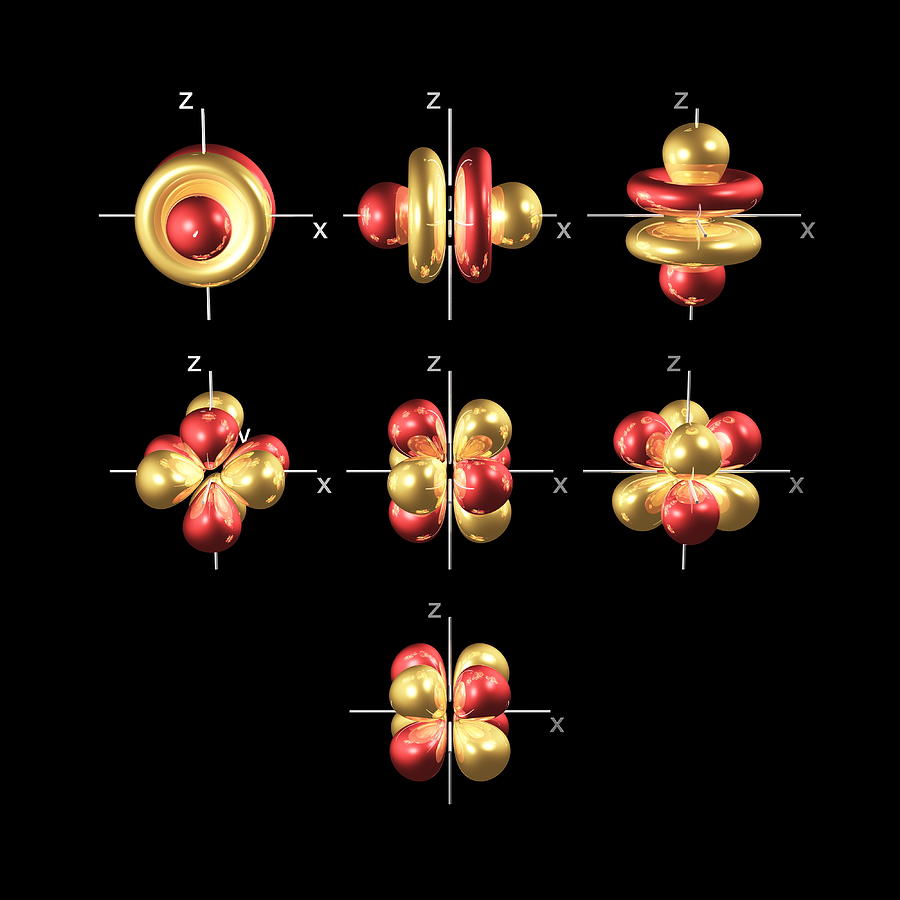
contando os orbitais 4s, 4p, e 4d, isto faz um total de 16 orbitais no quarto nível. Têm formas ainda mais complicadas. s, p, d, e f orbitais também estão disponíveis em todos os níveis de energia mais elevados. Felizmente, provavelmente não terá de memorizar as formas das orbitais f. Basta lembrar que existem sete orbitais f em cada nível, a partir do nível 4.