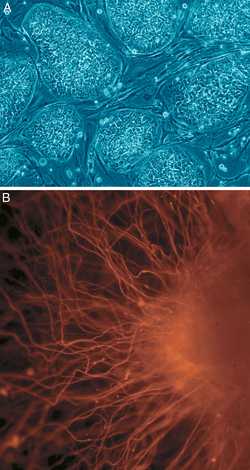
B: Células nervosas
Em biologia celular, pluripotência (Lat. pluripotência, “capacidade para muitos”) refere-se a uma célula estaminal que tem o potencial de se diferenciar em qualquer uma das três camadas germinativas: endoderme (revestimento interior do estômago, tracto gastrointestinal, pulmões), mesoderme (músculo, osso, sangue, urogenital), ou ectoderme (tecidos epidérmicos e sistema nervoso), mas não em tecidos extra-embrionários como a placenta. Contudo, a pluripotência celular é um continuum, variando desde a célula completamente pluripotente que pode formar cada célula do embrião propriamente dito, por exemplo, células estaminais embrionárias e iPSCs (ver abaixo), até à célula incompleta ou parcialmente pluripotente que pode formar células das três camadas germinativas mas que pode não apresentar todas as características das células completamente pluripotentes.
Pluripotência induzidaEdit
Células estaminais pluripotentes induzidas, normalmente abreviadas como células iPS ou iPSC, são um tipo de célula estaminal pluripotente artificialmente derivada de uma célula não pluripotente, tipicamente uma célula somática adulta, induzindo uma expressão “forçada” de certos genes e factores de transcrição. Estes factores de transcrição desempenham um papel fundamental na determinação do estado destas células e também realçam o facto de que estas células somáticas preservam a mesma informação genética que as células embrionárias iniciais. A capacidade de induzir células num estado pluripotente foi inicialmente pioneira em 2006, utilizando fibroblastos de rato e quatro factores de transcrição, Oct4, Sox2, Klf4 e c-Myc; esta técnica, denominada reprogramação, ganhou mais tarde Shinya Yamanaka e John Gurdon o Prémio Nobel em Fisiologia ou Medicina. Seguiu-se em 2007 a indução bem sucedida de iPSC humanos derivados de fibroblastos dérmicos humanos utilizando métodos semelhantes aos utilizados para a indução de células de rato. Estas células induzidas apresentam características semelhantes às das células estaminais embrionárias (ESC), mas não requerem a utilização de embriões. Algumas das semelhanças entre os CES e os iPSC incluem a pluripotência, morfologia, capacidade de auto-renovação, uma característica que implica que podem dividir-se e replicar-se indefinidamente, e expressão genética.
Factores electromagnéticos também se pensa estarem envolvidos na reprogramação real das células somáticas a fim de induzir a pluripotência. Tem-se teorizado que certos factores epigenéticos podem realmente funcionar para limpar as marcas epigenéticas somáticas originais, a fim de adquirir as novas marcas epigenéticas que fazem parte da obtenção de um estado pluripotente. A cromatina é também reorganizada em iPSC e torna-se semelhante à encontrada nos ESC, na medida em que é menos condensada e, portanto, mais acessível. As modificações de eucromatina também são comuns, o que também é consistente com o estado de eucromatina encontrado nos CES.
Devido à sua grande semelhança com os CES, os iPSCs têm sido de grande interesse para a comunidade médica e de investigação. Os iPSCs poderiam ter potencialmente as mesmas implicações e aplicações terapêuticas que os CES, mas sem o controverso uso de embriões no processo, um tópico de grande debate bioético. De facto, a pluripotência induzida de células somáticas em células iPS indiferenciadas foi originalmente saudada como o fim da controversa utilização de células estaminais embrionárias. No entanto, verificou-se que as iPSC eram potencialmente tumorigénicas, e, apesar dos avanços, nunca foram aprovadas para investigação na fase clínica nos Estados Unidos. Contratempos tais como baixas taxas de replicação e senescência precoce também foram encontrados ao fazer iPSC, impedindo a sua utilização como substitutos dos ESC.
Adicionalmente, foi determinado que a expressão somática de factores de transcrição combinados pode induzir directamente outros destinos de células somáticas definidos (transdiferenciação); os investigadores identificaram três factores de transcrição específicos da linhagem neural que poderiam converter directamente os fibroblastos do rato (células cutâneas) em neurónios totalmente funcionais. Este resultado desafia a natureza terminal da diferenciação celular e a integridade do compromisso da linhagem; e implica que com as ferramentas adequadas, todas as células são totipotentes e podem formar todos os tipos de tecido.
alguns dos possíveis usos médicos e terapêuticos para iPSCs derivados de pacientes incluem a sua utilização em transplantes de células e tecidos sem o risco de rejeição que é comum encontrar. Os iPSC podem potencialmente substituir modelos animais impróprios, bem como modelos in vitro utilizados para a investigação de doenças.

Estados de pluripotência ingénua vs. pluripotência primadaEditar
Descobertas recentes com respeito a epiblastos antes e depois da implantação produziram propostas para classificar a pluripotência em duas fases distintas: “ingénua” e “primed”. As células estaminais de base comummente utilizadas na ciência que são referidas como células estaminais embrionárias (ESCs) são derivadas de um epiblasto pré-implantação; tal epiblasto é capaz de gerar todo o feto, e uma célula epiblasto é capaz de contribuir para todas as linhagens celulares se injectada noutro blastocisto. Por outro lado, podem ser observadas várias diferenças marcantes entre os epiblastos pré e pós-implantação, tais como a sua diferença na morfologia, na qual o epiblasto após a implantação muda a sua morfologia para uma forma em forma de copo chamada “cilindro do ovo”, bem como a alteração cromossómica na qual um dos cromossomas X sob inactivação aleatória na fase inicial do cilindro do ovo, conhecida como activação X. Durante este desenvolvimento, as células epiblastos do cilindro do ovo são sistematicamente alvo de factores de crescimento Fibroblastos, sinalização Wnt, e outros factores indutivos através do saco vitelino circundante e do tecido trofoblasto, de modo a tornarem-se instructivamente específicas de acordo com a organização espacial.
Outra grande diferença que foi observada, no que diz respeito à potência celular, é que as células estaminais epiblastos pós-implantação são incapazes de contribuir para as quimeras blastocistos, o que as distingue de outras células estaminais pluripotentes conhecidas. As linhas celulares derivadas de tais epiblastos pós-implantação são referidas como células estaminais derivadas de epiblastos que foram derivadas pela primeira vez em laboratório em 2007; apesar da sua nomenclatura, que tanto os ESCs como os EpiSCs são derivados de epiblastos, apenas em fases diferentes de desenvolvimento, e que a pluripotência ainda está intacta nos epiblastos pós-implantação, como demonstrado pela expressão conservada de Nanog, Fut4, e Oct-4 nos EpiSCs, até à somitogénese e pode ser invertida a meio da expressão induzida de Oct-4.