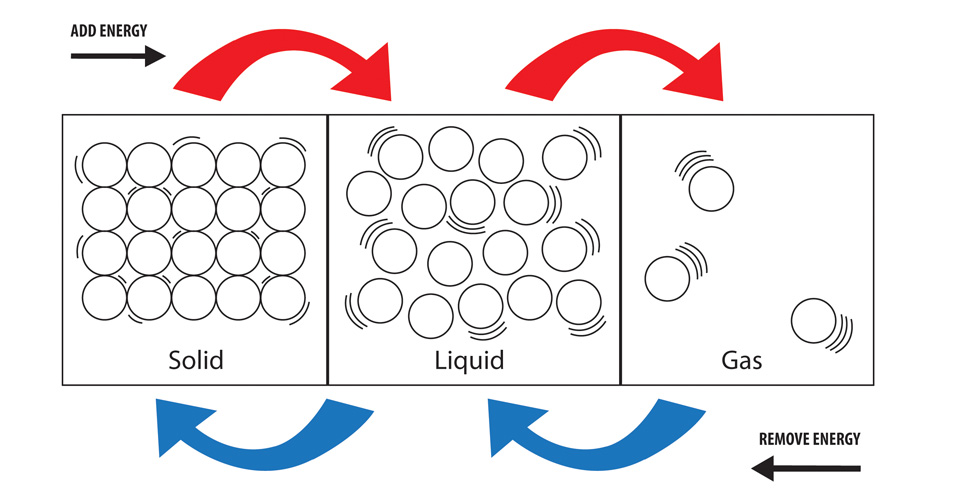
Num estado sólido as partículas têm a menor quantidade de energia em relação às do estado líquido e do estado gasoso (a maior quantidade de energia dos três estados). As ligações requerem energia para quebrar e libertar energia quando estão a ser formadas. Para formar um líquido a partir de um sólido, precisamos de quebrar as ligações e para formar um gás a partir de um líquido, precisamos de quebrar ainda mais ligações. Isto requer uma maior entrada de energia cada vez que mais ligações são quebradas.
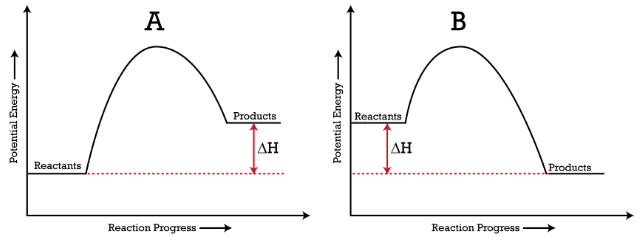
Processos endotérmicos ( gráfico A ) são onde a energia é absorvida por um sistema / reagentes e a energia das partículas envolvidas é maior do que antes de o processo ter ocorrido.
Processos endotérmicos ( gráfico B ) são o oposto de processos endotérmicos – a energia é libertada por um sistema / reagentes e as partículas envolvidas têm uma energia mais baixa após o processo do que antes.
Ligar isto aos estados sólido, líquido e gás, ao vaporizar uma substância (transformá-la num gás) está-se a promover as partículas da substância a um estado em que elas possuirão mais energia. Esta energia tem de ‘vir’ de algum lugar e assim a energia é retirada do meio envolvente do processo. Com as mudanças de estado, esta é normalmente sob a forma de calor (embora a pressão também possa ser factorada).
A condensação é um gás que se transforma num líquido e, portanto, um ‘estado’ de alta energia das partículas tornando-se um ‘estado’ de menor energia das partículas. Se a energia global das partículas envolvidas for menor do que antes da ocorrência do processo, a energia deve ter sido libertada e, portanto, o processo pode ser considerado exotérmico.