Ozone é um dos exemplos mais comuns utilizados para estudar a estrutura de Lewis. A molécula de Ozono tem três átomos de oxigénio. Está escrito como O3 nas equações químicas do núcleo. Para compreender a hibridização, polaridade e geometria molecular da molécula de Ozono é crucial conhecer a estrutura de Lewis da mesma.
| Nome da molécula | Ozono (O3) |
| No of Valence Electrons in the molecule | 18 |
| Hibridação de O3 | sp2 hibridização |
| ângulos de ligação | 116 graus |
| Geometria Molecular de O3 | Bent |
Now, muitas pessoas perguntam porque é necessário conhecer a estrutura de Lewis de qualquer molécula ou composto. A resposta a esta pergunta é simples; esta estrutura ajuda a compreender a estrutura básica, electrões que participam na formação da ligação juntamente com as cargas sobre um dado átomo.
A estrutura de Lewis baseia-se na regra do octeto. A regra do octeto estabelece que devem existir oito electrões na casca exterior ou órbita do átomo para que a molécula seja estável. A estrutura de Lewis ajuda a saber o número de elétrons de valência na molécula. Os electrões de valência são os electrões que participam na formação de pares de electrões de ligação e não ligação.
Os electrões que participam na formação da ligação são conhecidos como pares de electrões de ligação. Estes electrões são representados por linhas de desenho na estrutura de Lewis. Enquanto que os electrões que não participam na formação da ligação são pares de electrões sem ligação. Os pontos à volta do átomo central representam estes electrões.
Conteúdo
O3 electrões de valência
Em Ozono ou O3, há seis electrões de valência para cada molécula de Oxigénio.
Aqui, como existem três moléculas de oxigénio, o número total de electrões de valência é 6*3= 18,
Assim, existe um total de 18 electrões de valência disponíveis para a molécula de Ozono.
O3 Lewis Structure
Como a regra do octeto se aplica nesta estrutura, o átomo central é o primeiro que deve ter oito electrões na sua casca exterior. Assim, uma molécula do Oxigénio está no centro e as outras duas estão nos lados opostos.
O átomo central tem um único par de electrões e é estável devido aos oito electrões na sua órbita mais externa. Para satisfazer a regra do octeto, um átomo central precisa de formar uma ligação dupla em qualquer dos seus lados com uma molécula de Oxigénio e outra ligação única. Como ambas as moléculas de Oxigénio têm a mesma electronegatividade e estrutura, a dupla ligação continua a deslocar-se de ambas as moléculas.


Estruturas de ressonância de O3
No entanto, a estrutura do Ozono é única uma vez que o átomo central tem uma dupla ligação e uma única ligação com as suas moléculas de oxigénio vizinhas. Estas ligações continuam a permutar os seus lugares, e por isso o ozono tem uma estrutura de Lewis ressonante. A ressonância significa a constante troca das ligações entre as três moléculas do Ozono. O átomo central na estrutura de Lewis terá uma carga de +1 e o átomo formando uma única ligação terá -1 carga.


Hibridação O3
Hibridação em química significa a hibridação de dois ou mais níveis atómicos da mesma energia ou de energias diferentes para combinar e dar um novo orbital. Uma vez conhecida a estrutura de Lewis de uma molécula, é fácil conhecer a hibridação da mesma. Como o Ozono tem um átomo central de oxigénio com oito electrões na sua casca mais externa, a hibridação para o átomo central será sp2. Existem dois electrões na orbital 2s, enquanto que 6 electrões em ambas as orbitais 2p de três orbitais 2p. Como há electrões num orbital s, e dois orbitais p, a hibridação do átomo central de oxigénio torna-se sp2.
p>Outros dois átomos de oxigénio também têm hibridação. Um terá hibridização sp2, enquanto que o outro terá hibridização sp3, uma vez que existe um único par de electrões que cria ressonância na estrutura do Ozono. Como consideramos sempre a hibridação do átomo central como a hibridação final, o Ozono tem hibridação sp2.
Geometria Molecular O3
Como a hibridação da molécula determina a sua forma, podemos agora conhecer a geometria molecular do Ozono. O ozono tem hibridação sp2 significa que deve ter uma forma planar trigonal. Mas como a estrutura do Ozono tem ressonância e um único par de electrões, o ângulo entre as moléculas é inferior a 120 graus.
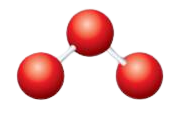

Ângulos de ligação do O3
Há sempre uma força repulsiva entre os electrões de ligação que é inferior à repulsão entre um par solitário e os electrões de ligação. Neste caso, como existe apenas um par de electrões solitários, há uma diminuição no ângulo de 120 para 116 graus.
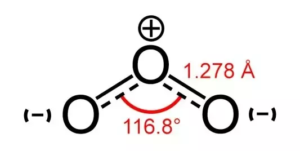

O3 Forma
Esta redução do ângulo de 120 para 116 graus provoca uma curva na forma, o que resulta numa forma trigonal planar distorcida. Muitas vezes a forma do Ozono é também considerada dobrada ou planar devido à sua distorção.
O3 Polar ou Não-Polar
A polaridade de cada molécula depende da sua geometria molecular. Aqui, a molécula de Ozono é dobrada devido aos seus electrões de valência. As três moléculas de Oxigénio não são lineares devido à sua hibridização sp2. Como as moléculas não estão em geometria linear, as suas interacções dipolo não são anuladas, e como resultado, existe um dipolo de rede nesta molécula. Assim, existe polaridade no Ozono, e pode dizer-se que o Ozono é polar. Esta polaridade é devida a um único par de electrões no átomo central do Ozono.
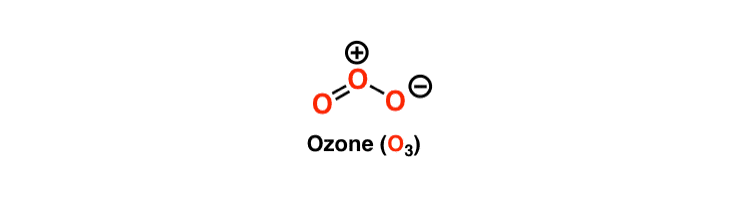

Observações finais
Para colocar tudo junto, podemos dizer que:
Ozono tem 18 valências de electrões dos quais existe um único par de electrões.
Tem hibridação sp2, geometria planar trigonal (dobrada/angular) e é polar.