O azoto é essencial à vida na Terra. É um componente de todas as proteínas, e pode ser encontrado em todos os sistemas vivos. Os compostos de nitrogénio estão presentes em materiais orgânicos, alimentos, fertilizantes, explosivos e venenos. O nitrogénio é crucial para a vida, mas em excesso também pode ser nocivo para o ambiente.
Nomeado após a palavra grega nitron, para “soda nativa”, e genes para “formar”, o nitrogénio é o quinto elemento mais abundante no universo. O gás nitrogénio constitui 78 por cento do ar da Terra, segundo o Laboratório Nacional de Los Alamos. Por outro lado, a atmosfera de Marte é apenas 2,6 por cento de azoto.
Na sua forma gasosa, o nitrogénio é incolor, inodoro e geralmente considerado como inerte. Na sua forma líquida, o azoto é também incolor e inodoro, e parece semelhante à água, segundo Los Alamos.
Apenas os factos
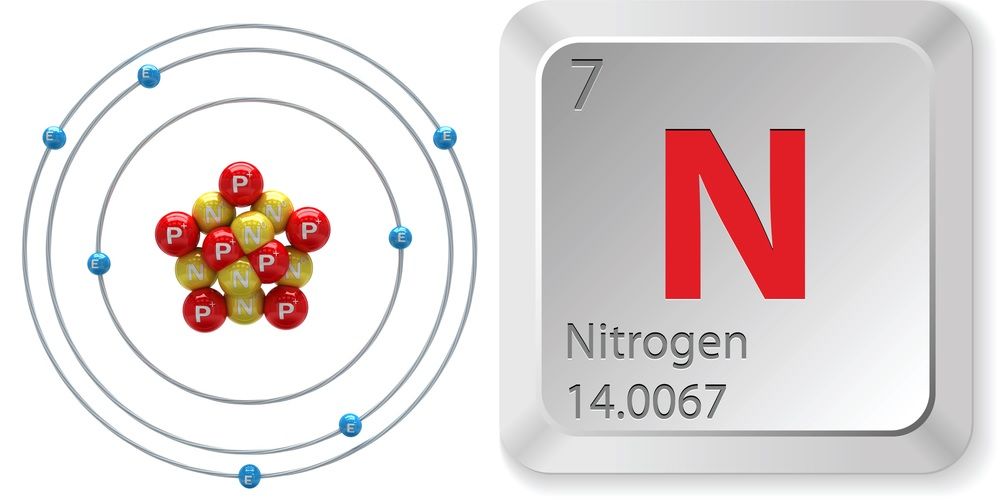
- Número atómico (número de prótons no núcleo): 7
- Símbolo atómico (na Tabela Periódica de Elementos): N
- Peso atómico (massa média do átomo): 14,0067
- Densidade: 0,0012506 gramas por centímetro cúbico
- Fase à temperatura ambiente: Gás
Ponto de fusão: menos 321 graus Fahrenheit (menos 210 graus Celsius)Ponto de fusão: menos 320,42 F (menos 195,79 C)Número de isótopos (átomos do mesmo elemento com um número diferente de neutrões): 16, incluindo 2 estáveisI>Isótopos mais comuns: Nitrogénio-14 (Abundância: 99.63 por cento)
Componente fertilizante
Nitrogénio foi descoberto em 1772 pelo químico e médico Daniel Rutherford, quando removeu oxigénio e dióxido de carbono do ar, demonstrando que o gás residual não suportaria organismos vivos ou combustão, de acordo com o Laboratório Nacional de Los Alamos. Outros cientistas, incluindo Carl Wilhelm Scheele e Joseph Priestly, estavam a trabalhar no mesmo problema, e chamavam ao nitrogénio ar “queimado”, ou ar sem oxigénio. Em 1786, Antoine Laurent de Lavoisier, chamou “azoto” ao nitrogénio, que significa “sem vida”. Isto foi baseado na observação de que é a parte do ar que não suporta a vida por si só.
Um dos mais importantes compostos de azoto é o amoníaco (NH3), que pode ser produzido no chamado processo Haber-Bosch, no qual o azoto reage com hidrogénio. O gás amoníaco incolor com odor pungente pode ser facilmente liquefeito num fertilizante de nitrogénio. De facto, cerca de 80 por cento do amoníaco que é produzido é utilizado como fertilizante. É também utilizado como gás refrigerante; no fabrico de plásticos, têxteis, pesticidas e corantes; e em soluções de limpeza, segundo o Departamento de Estado de Nova Iorque.
O ciclo do azoto
O ciclo do azoto, no qual o azoto atmosférico é convertido em diferentes compostos orgânicos, é um dos processos naturais mais cruciais para sustentar os organismos vivos. Durante o ciclo, as bactérias no processo do solo ou “fixam” o azoto atmosférico em amoníaco, que as plantas necessitam para crescer. Outras bactérias convertem o amoníaco em aminoácidos e proteínas. Depois, os animais comem as plantas e consomem as proteínas. Os compostos de azoto regressam ao solo através dos resíduos animais. As bactérias convertem o azoto residual em gás nitrogénio, que volta para a atmosfera.
Num esforço para que as culturas cresçam mais rapidamente, as pessoas utilizam o azoto em fertilizantes. Contudo, o uso excessivo desses fertilizantes na agricultura teve consequências devastadoras para o ambiente e a saúde humana, uma vez que contribuiu para a poluição das águas subterrâneas e de superfície. De acordo com a Agência de Protecção Ambiental dos EUA (EPA), a poluição dos nutrientes causada pelo excesso de azoto e fósforo no ar e na água, é um dos problemas ambientais mais generalizados, caros e desafiantes.
Combater o desequilíbrio
Uma das soluções para a questão do excesso de azoto reside na agricultura sustentável, na agricultura biológica e na sensibilização dos agricultores para estas questões ambientais, de acordo com Randy A. Dahlgren, professor de ciências do solo na Universidade da Califórnia, Davis.
“A ideia seria tentar eliminar a utilização destes fertilizantes comerciais e, em vez disso, utilizar resíduos orgânicos”, por exemplo, resíduos animais, disse ele. Outro passo seria a utilização de fertilizantes de libertação lenta com revestimentos de plástico e, em vez de libertar imediatamente o azoto, a libertação de azoto ocorre gradualmente ao longo da estação de crescimento, “tentando fazer corresponder a libertação de azoto do fertilizante revestido de plástico às necessidades da planta”, disse ele.
Microbiólogos da Universidade de Alberta no Canadá e da Universidade de Viena na Áustria podem ter descoberto outra solução. Em Agosto de 2017, os investigadores anunciaram que tinham identificado um micróbio oxidante de amoníaco chamado Nitrospira inopinata.
De acordo com os investigadores, Nitrospira inopinata é uma esponja de amónio, essencialmente superior a quase todos os outros tipos de bactérias e arcáceas (organismos unicelulares) na oxidação do amónio no ambiente. Como este micróbio é um oxidante tão eficiente, pode produzir menos óxido nitroso no processo.
As novas descobertas, que aparecem na revista científica Nature, podem ter implicações importantes na investigação das alterações climáticas. Os investigadores estão prontos para pôr este micróbio à prova através de uma variedade de aplicações práticas que poderiam reduzir os níveis de amónio no solo, na água e na atmosfera. Algumas destas aplicações poderiam envolver mudanças na nossa água potável, tratamentos de águas residuais e purificação do solo, segundo a Universidade de Alberta.
Quem diria?
- Even embora o termo “azoto” seja usado em inglês para se referir ao elemento, o termo Lavoisier “azote” ainda é usado em francês, e a sua forma está presente em “azoto” em italiano ou “azot” em polaco.
- O nitrogénio líquido é frequentemente utilizado como refrigerante, por exemplo, para armazenar esperma, ovos e outras células utilizadas em pesquisas médicas ou clínicas de fertilidade, de acordo com a Royal Society of Chemistry.
- O nitrogénio líquido é também utilizado para congelar rapidamente alimentos e ajudar a preservar o seu sabor, textura, humidade e sabor.
- Nitrogénio constitui 95% da atmosfera de Titã (a maior lua de Saturno), de acordo com o Laboratório de Propulsão a Jacto.
- Nitrogénio desempenha um papel na formação de uma aurora – uma exibição natural de luz no céu que pode ser predominantemente observada nas regiões árcticas e antárcticas – que ocorre quando os electrões de movimento rápido do espaço colidem com o oxigénio e azoto na nossa atmosfera, de acordo com a NASA.
- Nitrogénio gasoso pode ser obtido aquecendo uma solução de água de nitrato de amónio (NH4NO3), um sólido cristalino que é vulgarmente utilizado em fertilizantes.
- Sobre 150 toneladas de amoníaco são produzidas anualmente utilizando o processo Haber, de acordo com a Royal Society of Chemistry.
- Nitrogénio sob a forma de cloreto de amónio, NH4Cl, era produzido no antigo Egipto através do aquecimento de uma mistura de excrementos de animais, urina e sal, de acordo com a Royal Society of Chemistry.
- Nitroglicerina, um violento explosivo utilizado na produção de dinamite, é um líquido oleoso e incolor que contém azoto, oxigénio e carbono.
Relato adicional por Traci Pedersen, colaboradora da Live Science.