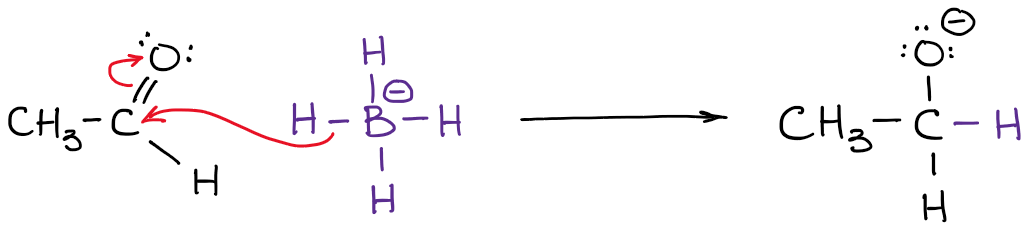Cargas formais em Química Orgânica é, talvez, um dos dispositivos de contabilidade mais fundamentais que é frequentemente mal compreendido ou negligenciado pelos estudantes.
Por que as cargas formais são importantes em Química Orgânica?
Conhecer as cargas formais pode ajudar-nos a compreender os padrões de reactividade nas reacções, encontrar centros reactivos, e fazer sentido fora do fluxo de electrões nos mecanismos. Por exemplo, as espécies carregadas negativamente tendem a ser as fontes de densidade de electrões nas reacções, enquanto que as espécies carregadas positivamente – aceitam esses electrões.
Aqui estão alguns exemplos de moléculas com cargas formais:
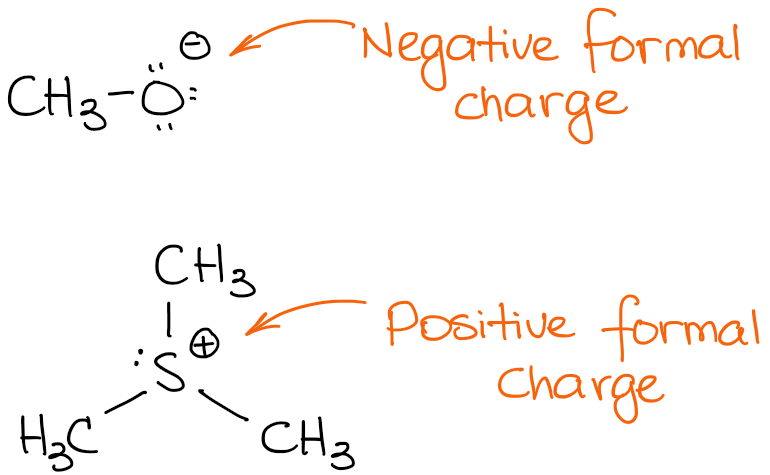
As espécies de topo têm uma carga negativa. Chamamos a essas espécies aniões. Uma vez que tem uma carga negativa, isso significa que tem um excesso de densidade de electrões. Assim, é provável que seja a fonte desses electrões numa reacção. As fontes de densidade de electrões numa reacção orgânica actuam como nucleófilos ou bases.
A segunda espécie suporta uma carga positiva, sendo assim uma espécie catiónica. Numa reacção, uma espécie catiónica será um aceitador de electrões actuando como um ácido (Brønsted ou Lewis) ou como um electrófilo.
É importante ter em mente que uma carga formal não é a mesma coisa que uma carga real! Falarei sobre isso um pouco mais tarde neste post.
Como calcular uma carga formal
A forma “oficial” é subtrair 1/2 electrões de ligação e electrões não de ligação de possíveis electrões de valência que um átomo pode ter. Por outras palavras:

Quais são todos esses termos?
Electrões de ligação são aqueles que compõem as ligações. Cada ligação contém 2 electrões. Assim, 1/2 dos electrões de ligação é igual ao número de ligações e o átomo tem.
Electrões de não ligação são aqueles que não participam em qualquer ligação. Por outras palavras, os electrões sem ligação são os electrões sobresselentes (geralmente pares de electrões) num átomo. Usando os exemplos de cima, temos:

As definições e o método “oficial” parecem um pouco feios. Como químico profissional, posso falar todo o dia sobre as “regras oficiais” e “nomes próprios” e aborrecer-vos até à morte. Em vez disso, preferia que usasse um simples “truque” que funciona sempre e, essencialmente, é a mesma coisa. O truque é:
Carga formal = Valence Electrons – Sticks – Dots
O número de Valence Electrons é igual ao grupo do elemento (coluna) na tabela periódica. Desta forma, o carbono tem 4, o oxigénio tem 6, e o hidrogénio tem 1 electrões de valência. As ligações e os electrões de reserva serão indicados (ou podem ser facilmente encontrados a partir) da estrutura da molécula Lewis. Assim, enquanto tiver uma estrutura Lewis completa e uma tabela periódica à mão, pode encontrar rapidamente a carga formal de qualquer átomo numa molécula.
A diferença entre a carga formal e a carga real
Agora, mencionei anteriormente que existe uma diferença entre a carga formal e a carga real. A carga formal é uma ferramenta de contabilidade que é importante para nos ajudar a acompanhar o fluxo de electrões na reacção.
A carga real, contudo, é a densidade real de electrões que está presente no átomo. Por exemplo, vejamos o anião boroidrido:

A electronegatividade do boro é 2.0 enquanto que a electronegatividade do hidrogénio é 2,2. Portanto, o hidrogénio é mais electronegativo (não por muito mas ainda assim) e polarizará a ligação. Isto significa que o hidrogénio realmente “puxa” a densidade de electrões para si próprio. Assim:
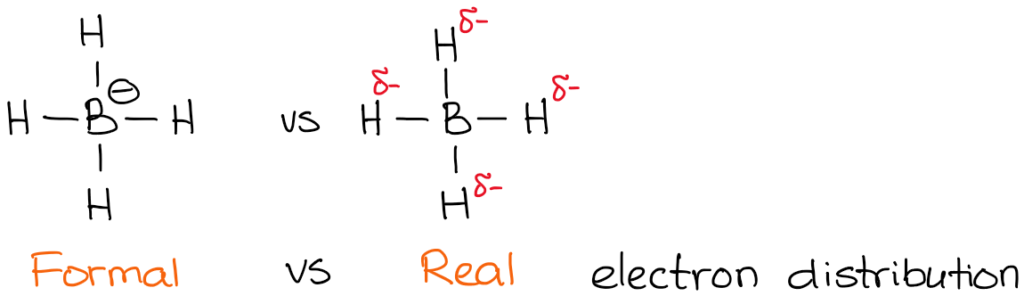
enquanto que as cargas formais são meramente uma “formalidade”,”são muito importantes para a compreensão dos mecanismos de reacção. Por conseguinte, é preciso ter a certeza de dominar a habilidade de encontrar rapidamente a carga formal.
Vocês também notam que indiquei as minhas densidades reais de electrões com o símbolo delta-minus (𝛿-). Isto denota que só tenho uma carga negativa parcial em cada um dos hidrógenos. Qual é a quantidade dessa carga parcial que temos sobre eles? Bem, poderíamos calculá-la utilizando cálculos químicos quânticos extravagantes, mas isso é totalmente desnecessário para efeitos de um curso típico de química orgânica. O que é mais importante, é perceber que o boro não é de facto carregado negativamente nesta molécula. Assim, quando escrevemos uma reacção com um anião boroidrido, não estaremos a mostrar electrões vindos do boro!