Talvez já tenha ouvido falar do composto químico que não tem ligações C-H. Tais compostos são conhecidos como ‘compostos inorgânicos’, uma vez que não são os orgânicos por falta de carbono. O trifluoreto de boro é o composto inorgânico, e a sua fórmula é BF3. Não contém qualquer cor, e é um gás tóxico. Cria fumos brancos no ar húmido. Se estiver na forma de um líquido incolor, é muito solúvel (dihidrato.)
Conteúdo
Geometria molecular de BF3
A geometria da molécula de BF3 é ‘Trigonal Planar’. Com a referência da Química, ‘Trigonal Planar’ é um modelo com três átomos à volta de um átomo no meio. É como átomos periféricos todos num plano, já que os três são semelhantes com os ângulos de ligação de 120° em cada um deles, o que os torna um triângulo equilátero.
BF3 Lewis Structure

Para conhecer a estrutura de BF3 Lewis, temos de calcular o número total de electrões de valência para a molécula de BF3. BF3 tem um total de 24 elétrons de valência, que temos de definir em torno do átomo central. Antes de completar os octetos, não se esqueça de determinar quantos electrões de valência há no Trifluoreto de Boro e colocá-los em conformidade.
Borão estará no centro da estrutura por ser menos electronegativo. Requer seis electrões de valência no seu invólucro exterior. Se verificarmos as cargas formais para a estrutura de Trifluoreto de Boro Lewis, verificaremos que são zero mesmo que Boro só tivesse seis electrões de valência.
Como desenhar a Estrutura de Lewis BF3?
Para desenhar uma Estrutura de Lewis, antes de mais nada, adicionar electrões e desenhar as conectividades. Conforme discutido, aqui há 24 electrões. Depois, adicionar octetos ao átomo exterior e electrões extra ao átomo central. Mas, como sabemos, não há electrões extra. (24 – 24 = 0)
Violações
Uma coisa a ter em mente ao desenhar a estrutura de Lewis é que a Regra do Octeto pode ser violada nestas três situações; mas, não precisamos de pensar nisso cada vez que é raro e estas excepções só ocorrerão quando necessário.
Excepção 1: Se houver um número ímpar de electrões de valência como 3,5,7, etc.
Excepção 2: Se houver muito poucos electrões de valência
Excepção 3: Se houver demasiados electrões de valência
Aqui, neste caso, o electrão central não tem nenhum octeto pois tem seis partículas. Portanto, tente adicionar mais do que uma ligação para decidir se o átomo central pode ou não alcançar um octeto!
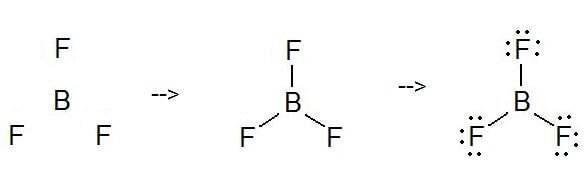
Como se pode ver, agora tem um octeto.
Hibridação BF3
Hibridação significa misturar orbitais atómicos em novos orbitais híbridos. São acomodantes para explicar a geometria molecular e as propriedades de ligação nuclear. Existem vários tipos de hibridização como SP3, SP2, SP. BF3 é a hibridização SP2. Para esta molécula, é SP2 porque é necessária uma ligação π (pi) para a ligação dupla entre o Boro e apenas três ligações σ são formadas por átomo de Boro. Os atómicos S – orbitais e P – orbitais em cascas exteriores de Boro misturam-se para formar três orbitais híbridos SP2 equivalentes.
BF3 Polaridade
Polaridade significa uma separação de carga eléctrica que leva a uma molécula ou aos seus grupos com um momento eléctrico dipolo ou multipolar. Se falamos de contradição, então a resposta é NÃO! BF3 é não-polar. Quando a diferença de electronegatividade entre os dois átomos é inferior a 0,5, é maioritariamente não-polar.

Espero que este artigo tenha feito sentido para si e o tenha ajudado a compreender BF3 Lewis Structure, Molecular Geometry, Hybridization, and Polarity. Fique atento para saber mais sobre as diferentes fórmulas e outras coisas importantes relativas à sua amada química.