CONCEITO DA GAP ANIÃO – A SUA DEFINIÇÃO E CÁLCULO
Plasma de dilatação é uma solução aquosa (água) contendo uma pletora de espécies químicas incluindo algumas que têm uma carga eléctrica líquida, resultado da dissociação de sais e ácidos no meio aquoso. Os que têm uma carga líquida positiva são chamados catiões e os que têm uma carga líquida negativa são chamados aniões; colectivamente, estas espécies carregadas electricamente são chamadas iões.
A lei da neutralidade electroquímica exige que, em comum com todas as soluções, o soro/plasma sanguíneo seja electroquimicamente neutro, de modo que a soma da concentração de cátions seja sempre igual à soma da concentração de ânions .
Esta lei imutável reflecte-se na FIGURA 1, uma exibição gráfica da concentração dos iões principais normalmente presentes no plasma/soro. É evidente que quantitativamente o cátion mais significativo no plasma é o sódio (Na+), e os ânions mais significativos são o cloreto (Cl-) e o bicarbonato HCO3-.
A concentração destes três constituintes do plasma (sódio, cloreto e bicarbonato) juntamente com o catião potássio (K+) são rotineiramente medidos no laboratório clínico como parte do perfil bioquímico mais frequentemente solicitado, ureia e electrólitos (U&E).
FIGURA 1: Anatomia iónica normal do soro
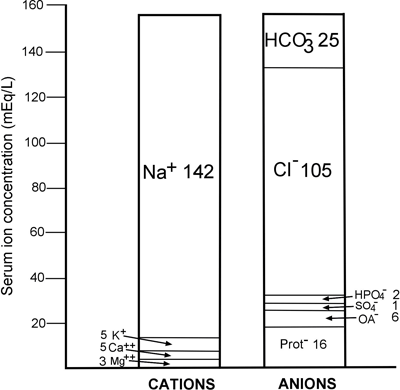
É evidente na FIGURA 1 que a concentração do catião sódio principal (142 mmol/L) excede as concentrações combinadas dos dois ânions principais, cloreto e bicarbonato (130 mmol/L) por 12 mmol/L.
Esta é a diferença entre a concentração de plasma/soro de sódio e a soma das concentrações de cloreto de plasma/soro e bicarbonato de sódio:
| Fenda aniónica (AG) (mmol/L) = – ( + ) Definição 1 | |
| Onde | = a concentração de plasma/soro de sódio (mmol/L) |
| = a concentração de plasma/soro de cloreto (mmol/L) | |
| = a concentração de bicarbonato de plasma/soro (mmol/L) | |
Uma alternativa, A definição menos frequentemente utilizada de fosso aniónico permite a inclusão do catião potássico (K+):
Anion gap (AG) (mmol/L) = ( + ) – ( + ) Definição 2
P>Assim, para um indivíduo com os seguintes valores de electrólito de plasma:
| Plasma sodium | 139 mmol/L |
| Plasma potassium | 4.0 mmol/L |
| A lacuna aniónica é | EITHER 139 – (103 + 26) = 10 mmol/L se for usada a definição 1 |
| OR (139 + 4.0) – (103+26) =14 mmol/L se for utilizada a definição 2. |
Felizmente, não existe consenso sobre qual das duas definições é adoptada, mas para uma interpretação precisa dos resultados dos pacientes é obviamente importante saber qual das duas definições foi utilizada. Para o resto deste artigo será utilizada a definição 1.
A diferença calculada entre aniões é uma construção artificial que apenas reflecte o facto de a concentração dos catiões comummente medidos exceder a concentração dos aniões comummente medidos.
A lei da neutralidade electroquímica exige que a lacuna de ânion total do soro, depois de ter em conta a concentração combinada de todos os catiões não medidos e de todos os ânions não medidos, deve ser zero:
Lacuna de ânion (AG) = ( + ) – ( + + ) = 0
Segue-se daí que a lacuna de ânion “calculada” reflecte uma desigualdade entre a concentração combinada de ânions não medidos e a concentração combinada de cátions não medidos , e destaca o ponto importante que a diferença de aniões calculada é tanto uma função da concentração de iões não medida como da concentração dos iões medidos (Na, Cl, HCO3) utilizados para fazer o cálculo. A partir da equação acima, podemos afirmar que:
+ = + + e por rearranjo
– ( + ) = –
e desde Anion gap (AG) = – ( + ) then
Anion gap (AG) = –
Assim, o intervalo de iões também pode ser definido como a diferença entre os cátions não medidos e os aniões não medidos .
ANION GAP – REFERENCE INTERVALO
Existe uma inconsistência na literatura relativamente ao intervalo de referência da fenda do anião . Tradicionalmente, o intervalo de referência era largamente aceite como sendo de 8-16 mmol/L se o potássio fosse excluído (definição 1) .
Esta aproximação é de 12-20 mmol/L se o potássio for incluído no cálculo do AG. Os resultados de vários estudos sugerem um intervalo de referência muito mais baixo de 3-10 mmol/L. Esta mudança no intervalo de referência é geralmente atribuída a uma mudança na metodologia utilizada para medir o sódio e o cloreto . A fotometria de chama foi outrora o único método de medição de sódio, e o cloreto era medido colorimetricamente.
No entanto, desde 1990, estas técnicas foram largamente abandonadas em favor da medição por eléctrodo selectivo de íons. Esta não pode ser a explicação completa porque continua a existir uma diferença significativa no intervalo aniónico calculado entre os analisadores modernos que utilizam todos eléctrodos selectivos de iões.
Por exemplo, Roberts et al compararam a diferença aniónica determinada utilizando três analisadores diferentes (todos utilizando eléctrodo selectivo de iões) e concluíram que o intervalo de referência tradicional mais elevado de 8-16 mmol/L estava próximo de ser apropriado para dois analisadores, mas inadequado para o terceiro.
Para este analisador o intervalo inferior de 3-10 mmol/L era muito mais apropriado.
Paulson et al também mostraram que o AG difere dependendo do sistema de medição. Eles calcularam o AG médio de sujeitos saudáveis para oito analisadores (todos utilizando eléctrodo selectivo de iões).
Os oito meios variavam de 5,9 mmol/L a 12 mmol/L. Assim, o intervalo de referência de 8-16 mmol/L foi considerado inteiramente apropriado para alguns analisadores, mas demasiado elevado para outros.
É evidente que cada laboratório deve determinar o seu próprio intervalo de referência, e os médicos não podem assumir que o tradicional intervalo de referência de 8-16 mmol/L, que ainda é amplamente citado nos textos médicos, é necessariamente apropriado para a interpretação dos resultados dos pacientes na sua instituição.
DEVIOLAÇÃO EM GAP ANIÃO
A fenda aniónica normal é uma ocorrência relativamente comum entre pacientes hospitalizados, sendo o aumento da fenda aniónica muito mais comum do que a redução da fenda aniónica.
Um estudo retrospectivo de 6868 conjuntos de electrólitos séricos entre pacientes hospitalizados, por exemplo, revelou incidências de aumento e redução da fenda aniónica a ser de 37,6% e 2,9%, respectivamente.
Desde que o cálculo preciso da fenda do anião requer uma medição precisa dos electrólitos, erros de laboratório aleatórios podem dar origem tanto a uma fenda do anião reduzida como a uma fenda do anião aumentada. Deve ser dada a devida consideração a esta possibilidade, se não for evidente uma causa patológica para o desvio da fenda do ânion.
PATOLOGICAL CAUSES OF REDUCED ANION GAP
Será evidente a partir da discussão anterior que a redução da fenda do ânion surgirá teoricamente se houver ou um aumento de cátions não medidos ou uma diminuição de ânions não medidos.
No pH fisiológico, a soma das cargas negativas sobre as proteínas normalmente presentes no soro excede em muito a soma das cargas positivas, de modo que as proteínas do soro são um contribuinte significativo para a totalidade dos ânions não medidos e um contribuinte insignificante para a totalidade dos catiões não medidos.
De facto, 80% da diferença de aniões é devida às proteínas do soro (ver FIGURA 1). Uma vez que a albumina é a mais abundante das proteínas predominantemente aniónicas no soro, não é surpreendente que a redução da albumina do soro (hipoalbuminemia) reduza o fosso aniónico.
Feldman et al determinaram que para cada 10 g/L de redução na albumina sérica, o intervalo de aniões do soro é reduzido em 2,3 mmol/L.
Hypoalbuminemia é a causa mais comum da redução do intervalo de aniões e alguns argumentaram que em populações de doentes como os gravemente doentes, que sofrem frequentemente de hipoalbuminemia, a correcção do intervalo de aniões para a concentração sérica de albumina é necessária para uma interpretação precisa do intervalo de aniões no soro.
A acumulação anormal de uma proteína sérica individual que tem uma carga positiva líquida (catião) tem o potencial de causar a redução do intervalo de aniões. A imunoglobulina IgG é uma dessas proteínas catiónicas.
As doentes que sofrem de mieloma IgG produzem grandes quantidades de IgG monoclonal (paraproteína) e, como consequência, têm frequentemente reduzido a lacuna do anião. Existe uma correlação negativa entre a concentração de paraproteína IgG monoclonal e o intervalo de aniões, e raramente o intervalo de aniões pode realmente ter um valor negativo em doentes com mieloma IgG. O aumento da IgG policlonal, independentemente da sua causa, está igualmente associado à redução da fenda do anião .
As com paraproteinemia monoclonal de IgG, quanto maior for a IgG, menor é a fenda do anião. O aumento de IgG policlonal é, por exemplo, a causa da redução da lacuna do anião evidente em doentes infectados com VIH .
Teoricamente, o aumento da concentração sérica dos catiões potássio, cálcio ou magnésio diminui a lacuna do anião.
Os aumentos observados na prática clínica raramente são suficientes de si mesmos para reduzir a diferença de ânion abaixo do limite do intervalo de referência, de modo que a hipercalemia, hipercalcemia e hipermagnesemia não são geralmente consideradas no diagnóstico diferencial da diferença de ânion reduzida.
No entanto, em doentes com hipoalbuminemia, e doentes com IgG elevado, o aumento de qualquer destes catiões pode muito bem contribuir para a redução da lacuna do anião.
O catião lítio (Li+), normalmente não presente no soro, está presente no soro daqueles carbonato de lítio prescrito, um fármaco utilizado para tratar a desordem bipolar.
A dose terapêutica está associada a uma concentração sérica de lítio de cerca de 1,0 mmol/L, que não é suficiente para afectar materialmente a lacuna de ânion, mas a overdose de lítio pode resultar numa lacuna de ânion reduzida ou mesmo, em casos de intoxicação grave, numa lacuna de ânion negativa. As principais causas da redução da fenda do anião estão resumidas na TABELA 1.
TABELA 1: Causas da baixa lacuna de ânion
p>p>Mais comunsbr>>p>Reduz a albumina sérica (hipoalbuminemia)br>>>br>>p>p>Menos comunsbr>>p>Paraaproteinemia mieloma de IgGbr>>p>Aumento da IgG policlonalbr>p>p>Lithium intoxicação>br>>br>>p> Causa primária teórica mas rarabr>>p>Cálcio plasmático elevado (hipercalcemia)br>p>P>Mágico plasmático elevado (hipermagesemia)br>
PATOLÓGICO DE CAUSAS DE ANIÃO RAZENTADA
Teóricamente, A diferença entre os aniões pode resultar quer de uma diminuição de cátions não medidos quer de um aumento de aniões não medidos. Na prática, é quase exclusivamente o resultado de um aumento de ânions não medidos derivados de ácidos metabólicos. A acidose metabólica é assim a causa mais comum do aumento do intervalo de aniões.
A anomalia primária que caracteriza a acidose metabólica, qualquer que seja a sua causa, é a redução da concentração de bicarbonato sérico (HCO3-). Isto pode ser devido ao aumento da utilização de bicarbonato em tamponamento da acumulação anormal de ácidos, aumento da perda de bicarbonato do organismo, ou regeneração inadequada do bicarbonato pelos rins.
Para manter a neutralidade electroquímica esta redução no ânion medido (bicarbonato) é acompanhada ou por um aumento no cloreto de soro (Cl-), o único outro ânion medido, ou muito mais comummente, por um aumento nos ânions não medidos.
No primeiro caso, porque a redução do bicarbonato medido é igualada pelo aumento do cloreto medido, o intervalo do anião permanece inalterado e normal; este tipo de acidose metabólica é chamado de acidose metabólica normal do anião (hiperclorémica). No segundo caso, porque há um aumento de ânions não medidos, a acidose metabólica é denominada de acidose metabólica com aumento do intervalo de ânions.
O intervalo de ânions tem provado ser tradicionalmente de valor no diagnóstico diferencial da acidose metabólica porque, dependendo da causa, a acidose metabólica está associada ou a um intervalo de ânions elevado ou, muito menos comummente, a um intervalo de ânions normal.
Trabalho recente revisto por Kraut & Madias revelou que esta utilidade da fenda do anião não é tão clara como se supunha.
O tópico principal aqui é as causas do aumento da acidose metabólica do intervalo de ânions, mas para completar as causas da acidose normal do intervalo de ânions (hiperclorémica), todas com excepção da diarreia bastante rara, estão listadas na TABELA 2.
TABELA 2: Causas da lacuna normal do anião (hipercloremia) acidose metabólica
p>Diarreiabr>>p>p>Pancreática, fístulas intestinais e biliaresbr>>p>acidose do túbulo renalbr>p>p>Cloreto mínimo (NH4CI) ingeridobr>>p>Insuficiência adrenal (hipoaldosteronismo)br>p>acumulação anormal de qualquer ácido que não contenha cloreto tem o potencial de causar um aumento da acidose metabólica da lacuna aniónica. À medida que o bicarbonato é consumido no tamponamento dos prótons (catião hidrogénio) do ácido, o ânion do ácido acumula-se, preservando assim a neutralidade electroquímica. Uma vez que o ânion acumulado é “desmedido”, o intervalo de ânion aumenta.
A acumulação de ácido láctico é provavelmente a causa mais comum da acidose metabólica. Aqui, a redução na concentração de bicarbonato resultante de prótons tamponantes de ácido láctico é acompanhada por um aumento na concentração do ácido láctico do anião “não medido”.
acidose láctica ocorre quando os tecidos são privados de oxigénio para que possa surgir numa série de doenças críticas (septicemia, enfarte do miocárdio, etc.), associadas ao colapso cardiovascular (choque), bem como traumas que envolvem perdas significativas de sangue. Uma série de drogas, sobretudo os biguanidas, metformina e fenformina, bem como o álcool, podem causar acidose láctica.
Lactato aumentado é uma causa tão comum de aumento do intervalo de aniões, especialmente entre os doentes críticos, que alguns propuseram que o intervalo de aniões prontamente disponível fosse utilizado como um instrumento de rastreio para o aumento do lactato neste grupo de doentes.
Acumulação anormal dos ceto-ácidos endógenos, β- ácido hidroxibutírico e ácido acetoacético, é a causa da acidose metabólica (cetoacidose) que ocorre na diabetes não tratada e na fome, quando na ausência de glicose intracelular as gorduras são mobilizadas como uma fonte de energia alternativa.
Aqui o aumento do intervalo de aniões é devido ao aumento da concentração sérica dos aniões “não medidos”, β-hydroxybutyrate e acetoacetato.
A excreção diminuída dos ácidos endógenos e seus aniões é a causa do aumento da acidose metabólica do intervalo de aniões, que é frequentemente uma característica da insuficiência renal.
Intoxicação com etilenoglicol e metanol causa o aumento do intervalo de aniões em virtude da acidose metabólica que resulta do seu metabolismo ao glicol e ao ácido fórmico, respectivamente .
A acidose piroglutâmica é uma causa rara, mas provavelmente subreconhecida, da acidose metabólica do intervalo elevado do anião . Kortmann et al relatam três histórias de casos, todos ocorrendo na mesma instituição num período de 6 meses.
A razão entre a variação do intervalo aniónico e a variação do bicarbonato (∆AG: ∆HCO3) pode ser utilizada para ajudar a identificar perturbações ácido-base coexistentes em doentes com acidose metabólica.
Esta utilidade do intervalo de aniões baseia-se na noção de que em casos de puro aumento do intervalo de aniões, acidose metabólica (acidose láctica, cetoacidose diabética, etc.), o aumento do intervalo de aniões em relação ao normal é igual à diminuição do bicarbonato em relação ao normal, de modo a que a razão seja 1 . A ∆AG: ∆HCO3 ratio de
A ratio de > 1 (aumento do AG superior à diminuição do bicarbonato) sugere uma alcalose metabólica coexistente ou uma acidose respiratória coexistente. Kraut & Madias fornece uma revisão crítica da validade desta utilização da diferença de aniões.
p> Embora a acidose metabólica seja quase sempre a causa de um aumento acentuado da diferença de aniões (i.e. AG > 25 mmol/L), não é necessariamente a causa em menor grau de aumento (AG 16-20 mmol/L).
Um número de outras condições pode dar origem a um ligeiro aumento da diferença aniónica. A elevação da albumina sérica (hiperalbuminemia) pode aumentar o intervalo de aniões pelo mesmo mecanismo que reduziu a albumina sérica (hipoalbuminemia) reduz o intervalo de aniões . Pequenos aumentos no intervalo de aniões (da ordem de 4-6 mmol/L) são evidentes em doentes que sofrem de alcalose metabólica não complicada por outros distúrbios ácido-base .
Isto permitiu a utilização do intervalo de aniões para ajudar a diferenciar o bicarbonato elevado da alcalose metabólica primária do bicarbonato elevado que surge durante a compensação metabólica da acidose respiratória. No primeiro caso o intervalo de ânion é elevado e no segundo o intervalo de ânion é normal.
Por um mecanismo semelhante que explica o intervalo de ânion reduzido em doentes com mieloma IgG, alguns doentes com mieloma IgA têm um intervalo de ânion elevado . Isto reflecte a observação de que algumas paraproteínas IgA do soro são aniónicas, em contraste com a IgG do soro, que é uma proteína catiónica.
As causas do aumento do intervalo de aniões estão listadas na TABELA 3.
TABELA 3: Principais causas do aumento do intervalo de ânions
br>>p>Associado à acidose metabólicabr>>p> Falha renalbr>>p>p>Cetoacidose diabéticabr>>p>Estirpe
p>Quetoacidose alcoólicabr>>p>acidose lácticabr>>p>>Intoxicação por etilenoglicolbr>>p>Intoxicação por metanolbr>>p>p>Intoxicação por toluenobr>>p>p>Piroglutâmico acidose (rara)>br>>>br>>p>Outras condiçõesbr>>p>Lbumina sérica elevada (hiperalbuminemia)br>>p>Álcalisose metabólicabr>>p>p>IgA mieloma (nem todos os casos)
SUMÁRIO
A lacuna aniónica é uma peça adicional de informação clínica que pode ser facilmente derivada sem custos a partir do perfil bioquímico mais frequentemente solicitado, ureia e electrólitos (U&E). Não é possível calcular a lacuna de aniões se o cloreto de soro não for incluído no perfil.
A principal utilização clínica do intervalo de aniões é na avaliação de perturbações ácido-base, particularmente acidose metabólica. O aumento marcado do intervalo de ânion (> 25 mmol/L) é quase invariavelmente evidência incontestável de acidose metabólica.
A distinção entre acidose metabólica normal e elevada do intervalo de aniões permite que o intervalo de aniões ajude a determinar a causa primária da acidose metabólica. O anion gap tem utilidade adicional na investigação de doentes que apresentam acidose metabólica associada a outro distúrbio ácido-base.
Fenda de ânion reduzida é, por comparação com o aumento da fenda de ânion, um achado raro que não está associado à perturbação do equilíbrio ácido-base mas pode ser indicativo de várias condições, incluindo hipoalbuminemia, mieloma e intoxicação por lítio.
A interpretação exacta dos resultados do intervalo de aniões é potencialmente dificultada pela falta de consenso sobre o método de cálculo e variabilidade significativa no intervalo de referência.
Errotério laboratorial (quer pré-analítico ou analítico) na medição de qualquer um ou de todos os três (ou quatro) parâmetros necessários para fazer o cálculo pode invalidar os resultados da lacuna aniónica. A lacuna aniónica é assim invulgarmente vulnerável a erro laboratorial.