Fórmulas moleculares
Las fórmulas moleculares dan el tipo y número de átomos de cada elemento presente en el compuesto molecular. En muchos casos, la fórmula molecular es la misma que la fórmula empírica. La fórmula química siempre será algún múltiplo entero (\(n\)) de la fórmula empírica (es decir, múltiplos enteros de los subíndices de la fórmula empírica).
Por lo tanto,
El múltiplo entero, n, también se puede obtener dividiendo la masa molar, \(MM\), del compuesto por la masa de la fórmula empírica, \(EFM\) (la masa molar representada por la fórmula empírica).
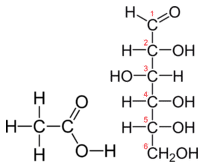
La tabla \(\PageIndex{1}) muestra la comparación entre la fórmula empírica y molecular del metano, el ácido acético y la glucosa, y los diferentes valores de n. La fórmula molecular del metano es \ce{CH_4} y como sólo contiene un átomo de carbono, ésa es también su fórmula empírica. Sin embargo, a veces la fórmula molecular es un simple múltiplo de número entero de la fórmula empírica. El ácido acético es un ácido orgánico que es el principal componente del vinagre. Su fórmula molecular es \ce{C_2H_4O_2}. La glucosa es un azúcar simple que las células utilizan como fuente primaria de energía. Su fórmula molecular es \ce{C_6H_{12}O_6}}. Las estructuras de ambas moléculas se muestran en la Figura \(\PageIndex{2}\). Son compuestos muy diferentes, sin embargo, ambos tienen la misma fórmula empírica de \ce{CH_2O}\}.
| Nombre del compuesto | Fórmula molecular | Fórmula empírica | n |
|---|---|---|---|
| Metano | (\ce{CH_4}) | (\ce{CH_4}) | 1 | Ácido acético | (\ce{C_2H_4O_2}) | (\ce{CH_2O}) | 2 |
| Glucosa | (\ce{C_6H_12}O_6}) | (\ce{CH_2O}) | 6 |
Las fórmulas empíricas pueden determinarse a partir de la composición porcentual de un compuesto, tal y como se explica en la sección 6.8. Para determinar su fórmula molecular, es necesario conocer la masa molar del compuesto. Los químicos utilizan un instrumento llamado espectrómetro de masas para determinar la masa molar de los compuestos. Para pasar de la fórmula empírica a la fórmula molecular, sigue estos pasos:
- Calcular la masa molar de la fórmula empírica (MEF).
- Dividir la masa molar del compuesto por la masa molar de la fórmula empírica. El resultado debe ser un número entero o muy cercano a un número entero.
- Multiplique todos los subíndices de la fórmula empírica por el número entero hallado en el paso 2. El resultado es la fórmula molecular.
- La masa molar de la fórmula empírica es un número entero. El resultado es la fórmula molecular.
Ejemplo \(\PageIndex{1})
La fórmula empírica de un compuesto de boro e hidrógeno es \(\ce{BH_3}). Su masa molar es \ (27,7 \: \text{g/mol}\). Determina la fórmula molecular del compuesto.
Solución
| Pasos para la resolución del problema | Determina la fórmula molecular de \(\ce{BH_3}\). | ||
|---|---|---|---|
|
Identifica la información «dada» y lo que el problema te pide que «encuentres».»
|
Dado: Fórmula empírica \(= \ce{BH_3}) Masa molecular \(= 27,7 \: \text{g/mol}) Encuentra: Fórmula molecular \(= ?\) |
||
| Calcular la masa de la fórmula empírica (MEF). | |||
| Divide la masa molar del compuesto por la masa de fórmula empírica. El resultado debe ser un número entero o muy cercano a un número entero. |
|
Multiplica todos los subíndices de la fórmula empírica por el número entero encontrado en el paso 2. El resultado es la fórmula molecular. | |
| Escribe la fórmula molecular. | La fórmula molecular del compuesto es \ce{B_2H_6}). | ||
| La masa molar de la fórmula molecular coincide con la masa molar del compuesto. |
La vitamina C (ácido ascórbico) contiene un 40,92 % de C, un 4,58 % de H y un 54,50 % de O, en masa. La masa molecular determinada experimentalmente es de 176 amu. ¿Cuáles son las fórmulas empíricas y químicas del ácido ascórbico?
Fórmula empírica C3H4O3
Fórmula molecular C6H8O6