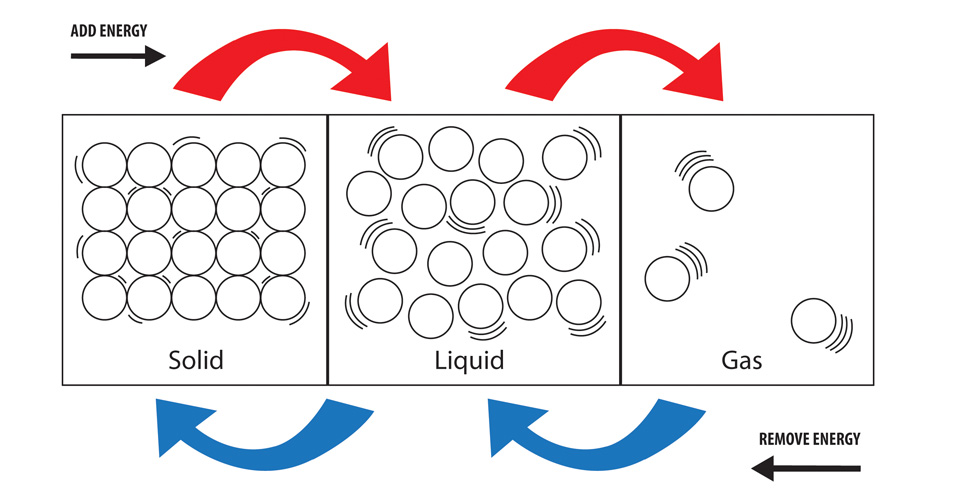
En un sólido las partículas tienen la menor cantidad de energía en relación con las que están en estado líquido y en estado gaseoso (la mayor cantidad de energía de los tres estados). Los enlaces requieren energía para romperse y liberan energía al formarse. Para formar un líquido a partir de un sólido, hay que romper enlaces y para formar un gas a partir de un líquido hay que romper aún más enlaces. Esto requiere un mayor aporte de energía cada vez que se rompen más enlaces.
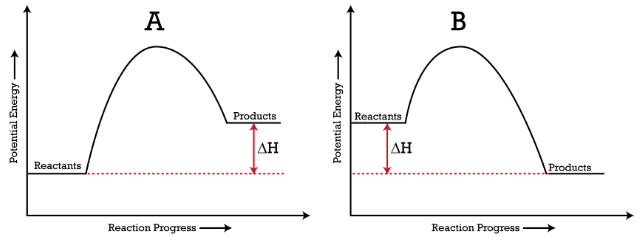
Los procesos endotérmicos ( gráfico A ) son aquellos en los que la energía es absorbida por un sistema/reaccionantes y la energía de las partículas implicadas es mayor que antes de que ocurriera el proceso.
Los procesos exotérmicos ( gráfico B ) son lo contrario a los procesos endotérmicos – la energía es liberada por un sistema / reactantes y las partículas involucradas tienen una energía menor después del proceso que antes.
Enlazando esto con los estados sólido, líquido y gaseoso, cuando vaporizas una sustancia (la conviertes en gas) estás promoviendo las partículas de la sustancia a un estado por el cual poseerán más energía. Esta energía tiene que «venir» de alguna parte, por lo que se toma energía del entorno del proceso. En el caso de los cambios de estado, esto suele ser en forma de calor (aunque también se puede tener en cuenta la presión).
La condensación es un gas que se convierte en líquido y, por lo tanto, un «estado» de partículas de alta energía se convierte en un «estado» de partículas de menor energía. Si la energía total de las partículas involucradas es menor que antes de que ocurriera el proceso, la energía debe haber sido liberada y por lo tanto el proceso puede ser considerado exotérmico.