Cada orbital se indica con un número y una letra.
El número indica el nivel de energía del electrón en el orbital. Así, el 1 se refiere al nivel de energía más cercano al núcleo; el 2 se refiere al siguiente nivel de energía más alejado, y así sucesivamente.
La letra se refiere a la forma del orbital. Las letras van en el orden s, p, d, f, g, h, i, j, etc. Las letras s, p, d y f se asignaron por razones históricas que no tienen por qué preocuparnos. Todo lo que tenemos que hacer es recordar las formas que corresponden a cada letra.
Como un electrón puede ocupar teóricamente todo el espacio, es imposible dibujar un orbital. Lo único que podemos hacer es dibujar una forma que incluya al electrón la mayor parte del tiempo, digamos el 95% del tiempo. A esta forma la llamamos contorno del 95%.
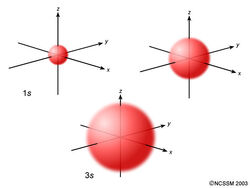
Un orbital s es esféricamente simétrico alrededor del núcleo del átomo, como una bola hueca hecha de material bastante esponjoso con el núcleo en su centro. A medida que aumentan los niveles de energía, los electrones se sitúan más lejos del núcleo, por lo que los orbitales se hacen más grandes. El orden de tamaño es 1s < 2s < 3s < …, como se muestra a continuación.
Ahora, veamos una sección transversal de estos orbitales.

Si te fijas bien, notarás que un orbital 1s tiene muy poca densidad de electrones cerca del núcleo, pero aumenta hasta un máximo a medida que te alejas del núcleo y luego disminuye más allá del contorno. Es algo así como una pelota de tenis hueca.
Un orbital 2s es similar a un orbital 1s, pero tiene una esfera de densidad de electrones dentro de la esfera exterior, como una pelota de tenis dentro de otra. Hay una superficie entre las dos pelotas donde la probabilidad de encontrar un electrón es nula. A esta superficie la llamamos nodo o superficie nodal.
Un orbital 3s es aún más grande, y tiene tres nodos.
p ORBITALES
No todos los electrones habitan en los orbitales s. En el primer nivel de energía, el único orbital disponible para los electrones es el orbital 1s. Sin embargo, en el segundo nivel, también hay orbitales llamados 2p además del orbital 2s.
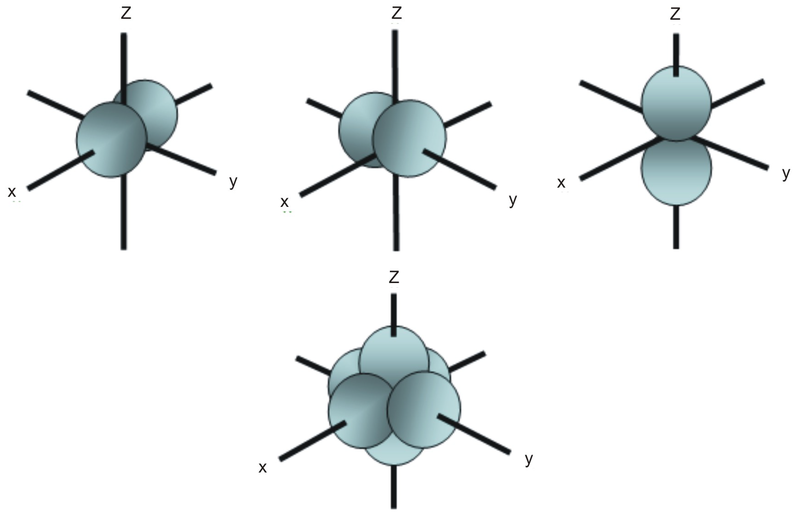
A diferencia de un orbital s, un orbital p apunta en una dirección particular. El que se muestra a continuación apunta hacia arriba y hacia abajo.

En cualquier nivel de energía, tenemos tres orbitales p absolutamente equivalentes que apuntan mutuamente en ángulo recto. A estos se les da arbitrariamente los símbolos px, py y pz. Esto es simplemente por conveniencia, porque lo que usted podría pensar como la dirección x, y o z cambia constantemente a medida que el átomo gira en el espacio.
Los orbitales p en el segundo nivel de energía se llaman 2px, 2py y 2pz. Hay orbitales similares en los niveles siguientes: 3px, 3py, 3pz, 4px, 4py, 4pz y así sucesivamente.
Todos los niveles excepto el primero tienen orbitales p.
Orbitales d
Además de los orbitales s y p, existen otros dos conjuntos de orbitales que pasan a estar disponibles para que los electrones los habiten en niveles de energía superiores. En el tercer nivel, hay un conjunto de cinco orbitales d (con formas y nombres complicados), así como los orbitales 3s y 3p (3px, 3py, 3pz). En el tercer nivel hay un total de nueve orbitales en total.
Los cinco orbitales 3d se llaman
3dxy
3dxz
3dyz
3dx² – y²
3dz²

Para dar sentido a los nombres, tenemos que verlos en dos grupos. El primer grupo contiene los orbitales 3dxy, 3dxz y 3dyz. Los nombres indican que estos orbitales se encuentran en el plano x-y, en el plano x-z y en el plano y-z, respectivamente. Cada orbital tiene cuatro lóbulos, y cada uno de los lóbulos apunta entre dos de los ejes, no a lo largo de ellos.
El segundo grupo contiene los orbitales 3dx² – y² y 3dz². Sus lóbulos apuntan a lo largo de los distintos ejes.
El orbital 3dx² – y² se parece exactamente al primer grupo, excepto que los lóbulos apuntan a lo largo de los ejes x e y, no entre ellos.
El 3dz² parece un orbital p que lleva un donut en la cintura.
Orbitales f
En el cuarto nivel y superiores, hay siete orbitales f además de los orbitales 4s, 4p y 4d.
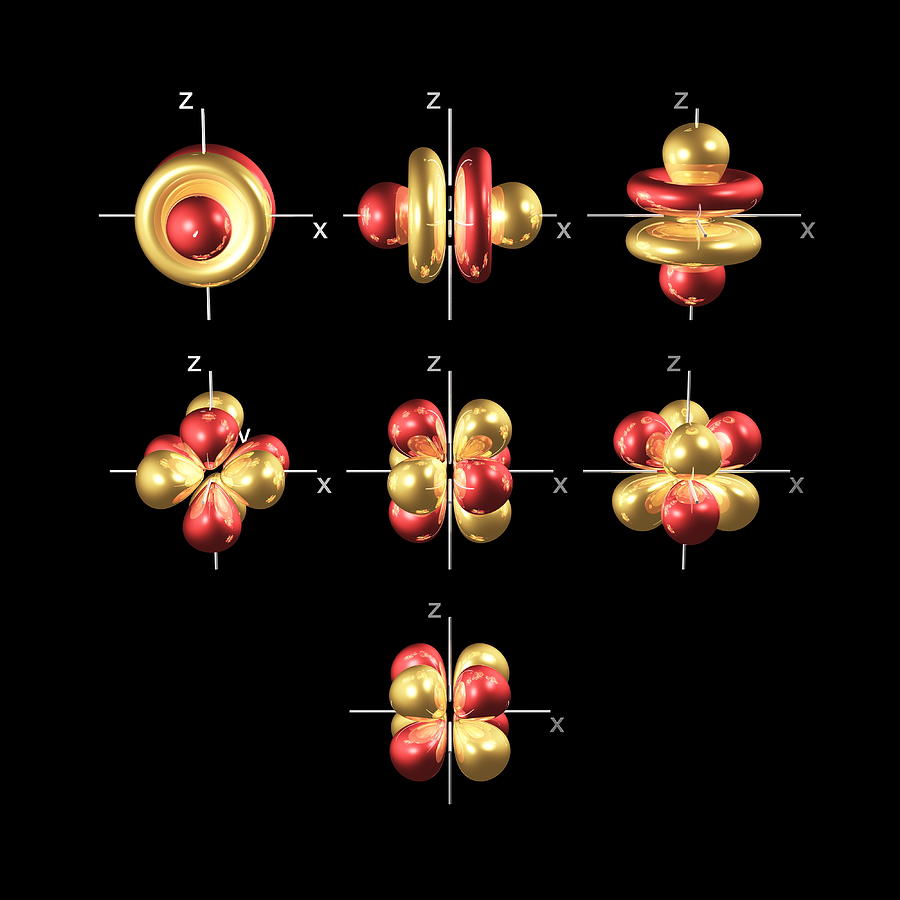
Contando los orbitales 4s, 4p y 4d, esto hace un total de 16 orbitales en el cuarto nivel. Los orbitales s, p, d y f también están disponibles en todos los niveles de energía superiores. Afortunadamente, probablemente no tendrá que memorizar las formas de los orbitales f. Sólo recuerda que hay siete orbitales f en cada nivel a partir del nivel 4.