El ozono es uno de los ejemplos más comunes utilizados para estudiar la estructura de Lewis. La molécula de Ozono tiene tres átomos de oxígeno. Se escribe como O3 en las ecuaciones de química básica. Para entender la hibridación, polaridad y geometría molecular de la molécula de Ozono es crucial conocer la estructura de Lewis de la misma.
| Nombre de la molécula | Ozono (O3) |
| Número de electrones de valencia en la molécula | 18 |
| Hibridación de O3 | Hibridación sp2 | Ángulos de enlace | 116 grados | Geometría molecular del O3 | Doblado |
Ahora, mucha gente se pregunta por qué es necesario conocer la estructura de Lewis de cualquier molécula o compuesto. La respuesta a esta pregunta es sencilla; esta estructura ayuda a comprender la estructura básica, los electrones que participan en la formación de enlaces junto con las cargas de un átomo determinado.
La estructura de Lewis se basa en la regla del octeto. La regla del octeto establece que debe haber ocho electrones en la capa u órbita exterior del átomo para que la molécula sea estable. La estructura de Lewis ayuda a conocer el número de electrones de valencia de la molécula. Los electrones de valencia son los electrones que participan en la formación de pares de electrones enlazantes y no enlazantes.
Los electrones que participan en la formación de enlaces se conocen como pares de electrones enlazantes. Estos electrones se representan dibujando líneas en la estructura de Lewis. Mientras que los electrones que no participan en la formación del enlace son pares de electrones no enlazantes. Los puntos alrededor del átomo central representan estos electrones.
Ectrones de valencia del O3
En el Ozono u O3, hay seis electrones de valencia por cada molécula de Oxígeno.
Aquí como hay tres moléculas de oxígeno, el número total de electrones de valencia es 6*3= 18.
Así que hay un total de 18 electrones de valencia disponibles para la molécula de Ozono.
Estructura de Lewis del O3
Como en esta estructura se aplica la regla del octeto, el átomo central es el primero que debe tener ocho electrones en su capa exterior. Así que una molécula del Oxígeno está en el centro con las otras dos están en los lados opuestos.
El átomo central tiene un par solitario de electrones y es estable debido a los ocho electrones en su órbita más externa. Para satisfacer la regla del octeto, un átomo central necesita formar un doble enlace en cualquiera de sus lados con una molécula de Oxígeno y otro enlace simple. Como ambas moléculas de Oxígeno tienen la misma electronegatividad y estructura, el doble enlace sigue desplazándose de ambas moléculas.


Estructuras de resonancia del O3
Sin embargo, la estructura del ozono es única ya que el átomo central tiene un doble enlace y un enlace simple con sus moléculas de oxígeno vecinas. Estos enlaces siguen intercambiando sus lugares, y por lo tanto el ozono tiene una estructura resonante de Lewis. La resonancia significa el intercambio constante de los enlaces entre las tres moléculas del ozono. El átomo central en la estructura de Lewis tendrá una carga de +1 y el átomo que forma un solo enlace tendrá una carga de -1.


Hibridación del O3
La hibridación en química significa la hibridación de dos o más niveles atómicos de igual o diferente energía para combinarse y dar un nuevo orbital. Una vez que conocemos la estructura de Lewis de una molécula, es fácil conocer la hibridación de la misma. Como el ozono tiene un átomo central de oxígeno con ocho electrones en su capa más externa, la hibridación del átomo central será sp2. Hay dos electrones en el orbital 2s, mientras que 6 electrones en ambos orbitales 2p de tres orbitales 2p. Como hay electrones en un orbital s, y dos orbitales p, la hibridación del átomo de oxígeno central se convierte en sp2.
Los otros dos átomos de oxígeno también tienen hibridación. Uno tendrá hibridación sp2, mientras que, el otro tendrá hibridación sp3 ya que hay un par solitario de electrones que crea resonancia en la estructura del Ozono. Como siempre consideramos la hibridación del átomo central como la hibridación final, el Ozono tiene hibridación sp2.
Geometría Molecular del O3
Como la hibridación de la molécula determina su forma, ahora podemos conocer la geometría molecular del Ozono. El Ozono tiene hibridación sp2, lo que significa que debería tener una forma planar trigonal. Pero como la estructura del Ozono tiene resonancia y un par de electrones solitarios, el ángulo entre las moléculas es inferior a 120 grados.

Ángulos de enlace del O3
Siempre hay una fuerza de repulsión entre los electrones de enlace que es menor que la repulsión entre un par de soles y los electrones de enlace. En este caso, como sólo hay un par de electrones solitarios, hay una disminución del ángulo de 120 a 116 grados.
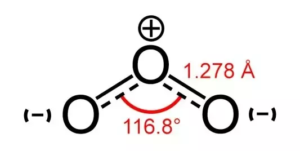

Forma del O3
Esta reducción del ángulo de 120 a 116 grados provoca una flexión de la forma, que da lugar a una forma trigonal plana distorsionada. Muchas veces la forma del Ozono también se considera doblada o planar debido a su distorsión.
O3 Polar o no polar
La polaridad de cada molécula depende de su geometría molecular. Aquí, la molécula de Ozono está doblada debido a sus electrones de valencia. Las tres moléculas de Oxígeno no son lineales debido a su hibridación sp2. Como las moléculas no están en geometría lineal sus interacciones dipolares no se anulan, y como resultado hay un dipolo neto en esta molécula. Por lo tanto, hay polaridad en el ozono, y se puede decir que el ozono es polar. Esta polaridad se debe a un par de electrones solitarios en el átomo central del Ozono.
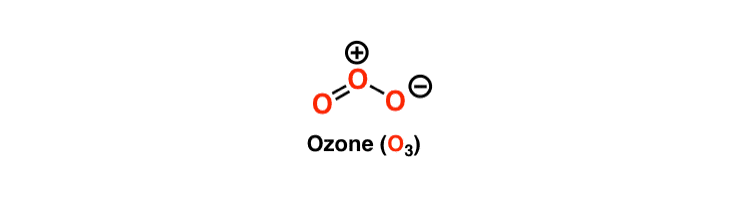

Observaciones finales
Para poner todo junto, podemos decir que:
El Ozono tiene 18 electrones de valencia de los cuales hay un par de electrones solitarios.
Tiene hibridación sp2, geometría trigonal plana («bent/angular») y es polar.