El nitrógeno es esencial para la vida en la Tierra. Es un componente de todas las proteínas y se encuentra en todos los sistemas vivos. Los compuestos de nitrógeno están presentes en materiales orgánicos, alimentos, fertilizantes, explosivos y venenos. El nitrógeno es crucial para la vida, pero en exceso también puede ser perjudicial para el medio ambiente.
Nombrado así por la palabra griega nitron, que significa «refresco nativo», y genes, que significa «formación», el nitrógeno es el quinto elemento más abundante del universo. El gas nitrógeno constituye el 78% del aire de la Tierra, según el Laboratorio Nacional de Los Álamos. En cambio, la atmósfera de Marte sólo tiene un 2,6 por ciento de nitrógeno.
En su forma gaseosa, el nitrógeno es incoloro, inodoro y generalmente considerado como inerte. En su forma líquida, el nitrógeno también es incoloro e inodoro, y tiene un aspecto similar al del agua, según Los Álamos.
Sólo los datos
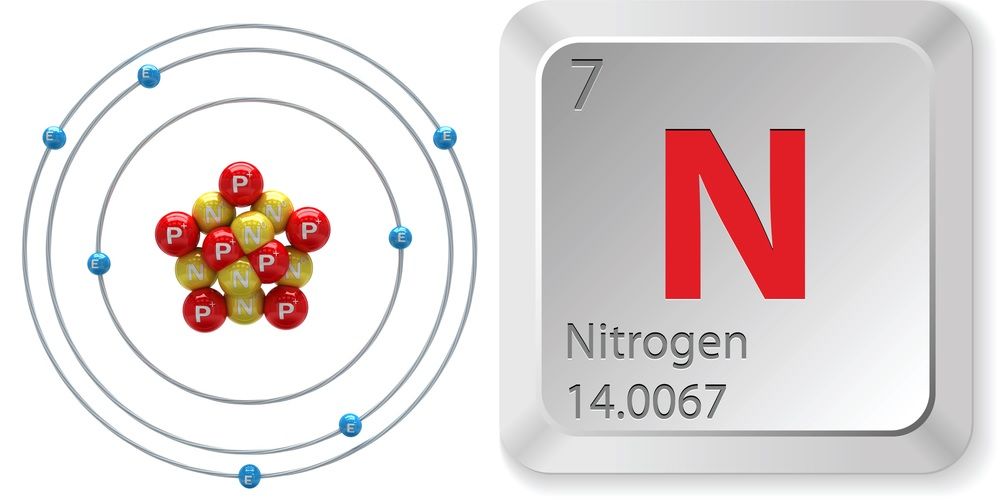
- Número atómico (número de protones en el núcleo): 7
- Símbolo atómico (en la Tabla Periódica de los Elementos): N
- Peso atómico (masa media del átomo): 14,0067
- Densidad: 0,0012506 gramos por centímetro cúbico
- Fase a temperatura ambiente: Gas
- Punto de fusión: menos 321 grados Fahrenheit (menos 210 grados Celsius)
- Punto de ebullición: menos 320,42 F (menos 195,79 C)
- Número de isótopos (átomos del mismo elemento con diferente número de neutrones): 16 incluyendo 2 estables
- Isótopos más comunes: Nitrógeno-14 (Abundancia: 99.63 por ciento)
Componente del fertilizante
El nitrógeno fue descubierto en 1772 por el químico y médico Daniel Rutherford, cuando extrajo el oxígeno y el dióxido de carbono del aire, demostrando que el gas residual no soportaba los organismos vivos ni la combustión, según el Laboratorio Nacional de Los Álamos. Otros científicos, como Carl Wilhelm Scheele y Joseph Priestly, trabajaban en el mismo problema y llamaban al nitrógeno aire «quemado», o sea, sin oxígeno. En 1786, Antoine Laurent de Lavoisier, llamó al nitrógeno «azote», que significa «sin vida». Esto se basó en la observación de que es la parte del aire no puede soportar la vida por sí mismo.
Uno de los compuestos de nitrógeno más importantes es el amoníaco (NH3), que puede producirse en el llamado proceso Haber-Bosch, en el que el nitrógeno reacciona con el hidrógeno. El gas amoníaco incoloro y de olor penetrante puede licuarse fácilmente para obtener un fertilizante nitrogenado. De hecho, cerca del 80% del amoníaco que se produce se utiliza como fertilizante. También se utiliza como gas refrigerante; en la fabricación de plásticos, textiles, pesticidas y tintes; y en soluciones de limpieza, según el Departamento de Estado de Nueva York.
El ciclo del nitrógeno
El ciclo del nitrógeno, en el que el nitrógeno atmosférico se convierte en diferentes compuestos orgánicos, es uno de los procesos naturales más cruciales para el mantenimiento de los organismos vivos. Durante el ciclo, las bacterias del suelo procesan o «fijan» el nitrógeno atmosférico en amoníaco, que las plantas necesitan para crecer. Otras bacterias convierten el amoníaco en aminoácidos y proteínas. Después, los animales se comen las plantas y consumen las proteínas. Los compuestos de nitrógeno vuelven al suelo a través de los desechos de los animales. Las bacterias vuelven a convertir el nitrógeno de desecho en gas nitrógeno, que vuelve a la atmósfera.
En un esfuerzo por hacer que los cultivos crezcan más rápido, la gente utiliza nitrógeno en los fertilizantes. Sin embargo, el uso excesivo de esos fertilizantes en la agricultura ha tenido consecuencias devastadoras para el medio ambiente y la salud humana, ya que ha contribuido a la contaminación de las aguas subterráneas y superficiales. Según la Agencia de Protección Medioambiental de Estados Unidos (EPA), la contaminación por nutrientes causada por el exceso de nitrógeno y fósforo en el aire y el agua, es uno de los problemas medioambientales más extendidos, costosos y desafiantes.
Abordar el desequilibrio
Una de las soluciones al problema del exceso de nitrógeno pasa por la agricultura sostenible, la agricultura ecológica y la concienciación de estos problemas medioambientales entre los agricultores, según Randy A. Dahlgren, profesor de ciencias del suelo en la Universidad de California, Davis.
«La idea sería tratar de eliminar el uso de estos fertilizantes comerciales y, en su lugar, utilizar residuos orgánicos», por ejemplo, residuos animales, dijo. Otro paso sería utilizar fertilizantes de liberación lenta que tienen recubrimientos de plástico y, en lugar de liberar el nitrógeno de inmediato, la liberación de nitrógeno se produce gradualmente a lo largo de la temporada de crecimiento, «tratando de hacer coincidir la liberación de nitrógeno del fertilizante recubierto de plástico con las necesidades de la planta», dijo.
Los microbiólogos de la Universidad de Alberta en Canadá y la Universidad de Viena en Austria pueden haber descubierto otra solución. En agosto de 2017, los investigadores anunciaron que habían identificado un microbio que oxida el amoníaco llamado Nitrospira inopinata.
Según los investigadores, Nitrospira inopinata es una esponja de amonio, que esencialmente supera a casi todos los demás tipos de bacterias y arqueas (organismos unicelulares) en la oxidación del amonio en el medio ambiente. Como este microbio es un oxidante tan eficiente, puede producir menos óxido nitroso en el proceso.
Los nuevos hallazgos, que aparecen en la revista científica Nature, podrían tener importantes implicaciones para la investigación del cambio climático. Los investigadores están dispuestos a poner a prueba este microbio mediante una serie de aplicaciones prácticas que podrían reducir los niveles de amonio en el suelo, el agua y la atmósfera. Algunas de estas aplicaciones podrían implicar cambios en nuestra agua potable, tratamientos de aguas residuales y purificación del suelo, según la Universidad de Alberta.
¿Quién lo iba a decir?
- Aunque en inglés se utiliza el término «nitrogen» para referirse al elemento, en francés se sigue utilizando el término de Lavoisier «azote», y su forma está presente en «azoto» en italiano o «azot» en polaco.
- El nitrógeno líquido se utiliza con frecuencia como refrigerante, por ejemplo, para almacenar esperma, óvulos y otras células utilizadas en la investigación médica o en las clínicas de fertilidad, según la Royal Society of Chemistry.
- El nitrógeno líquido también se utiliza para congelar rápidamente los alimentos y ayudar a conservar su sabor, textura, humedad y aroma.
- El nitrógeno constituye el 95 por ciento de la atmósfera de Titán (la luna más grande de Saturno), según el Laboratorio de Propulsión a Chorro.
- El gas nitrógeno desempeña un papel en la formación de una aurora -un despliegue natural de luz en el cielo que puede observarse predominantemente en las regiones árticas y antárticas- que se produce cuando los electrones de movimiento rápido procedentes del espacio chocan con el oxígeno y el nitrógeno de nuestra atmósfera, según la NASA.
- El nitrógeno gaseoso se puede obtener calentando una solución acuosa de nitrato de amonio (NH4NO3), un sólido cristalino que se utiliza habitualmente en los fertilizantes.
- Alrededor de 150 toneladas de amoníaco se producen cada año mediante el proceso Haber, según la Royal Society of Chemistry.
- El nitrógeno en forma de cloruro de amonio, NH4Cl, se producía en el antiguo Egipto calentando una mezcla de excrementos de animales, orina y sal, según la Royal Society of Chemistry.
- La nitroglicerina, un violento explosivo utilizado en la producción de dinamita, es un líquido aceitoso e incoloro que contiene nitrógeno, oxígeno y carbono.
Información adicional de Traci Pedersen, colaboradora de Live Science.