US Pharm. 2013;38(12):38-42.
ABSTRACT: Los inhibidores de la bomba de protones (IBP), disponibles con o sin receta, se utilizan habitualmente para el tratamiento de los trastornos relacionados con la acidez. A pesar de su fácil disponibilidad y uso común, los IBP pueden tener efectos secundarios graves. Las consecuencias a largo plazo del uso crónico de IBP incluyen el posible aumento del riesgo de hipocalcemia, hipomagnesemia, infecciones por Clostridium difficile y neumonía. Los farmacéuticos comunitarios están preparados para proporcionar recomendaciones basadas en la evidencia y educar a los pacientes sobre los beneficios y los riesgos asociados al uso crónico de IBP.
Los inhibidores de la bomba de protones (IBP) están en el mercado desde finales de la década de 1980 y han sustituido a los antagonistas de los receptores de la histamina2 (ARH2) como la clase de fármacos más potente para el tratamiento de las enfermedades relacionadas con la acidez.1 Los medicamentos antiulcerosos (las áreas terapéuticas se basan en definiciones propias de IMS Health) fueron la novena clase más importante en función del volumen de prescripción en Estados Unidos en 2012 y la undécima en ventas.2,3
Los medicamentos de la clase IBP están ampliamente disponibles con o sin receta. Actualmente, el mercado estadounidense contiene seis IBP, dos de los cuales también están disponibles como productos de venta libre (TABLA 1)4-9. A principios de la década de 2000, la FDA anunció la disponibilidad de omeprazol (Prilosec OTC) como el primer IBP de venta libre10. Poco después se aprobó el lansoprazol de venta libre (Prevacid 24HR).11
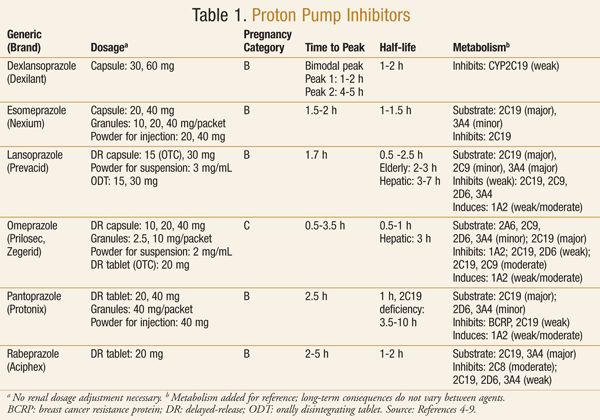
Los IBP se utilizan para el tratamiento de muchas afecciones gástricas, como la enfermedad de úlcera péptica, la erradicación de infecciones por Helicobacter pylori, el tratamiento y la prevención de la úlcera gastroduodenal por medicamentos antiinflamatorios no esteroideos (AINE), el síndrome de Zollinger-Ellison y la enfermedad por reflujo gastroesofágico (ERGE).1 Generalmente, estos medicamentos se prescriben debido a la baja incidencia de efectos secundarios y a la eficacia superior en comparación con otros fármacos utilizados para tratar las mismas afecciones.1
El uso a largo plazo de cualquier medicamento plantea problemas de seguridad, especialmente si ese producto está disponible sin receta médica. La Asociación Americana de Gastroenterología (AGA) publicó en 2008 unas directrices sobre el manejo de la ERGE en las que se desaconsejaba el control rutinario de los IBP debido a la insuficiencia de pruebas.12 Sin embargo, desde entonces los estudios han seguido mostrando las consecuencias a largo plazo del uso crónico de los IBP, incluyendo consecuencias de malabsorción e infecciones. Posteriormente, en marzo de 2013, el Colegio Americano de Gastroenterología (ACG) publicó unas directrices para el diagnóstico y el tratamiento de la ERGE.13 Estas directrices sí aportan alguna idea sobre la monitorización de las consecuencias a largo plazo del uso crónico de IBP. Este artículo es una revisión de la literatura reciente y de las recomendaciones de las directrices en relación con las posibles consecuencias a largo plazo de la farmacoterapia crónica con IBP y las oportunidades para prevenir estas complicaciones.
En estudios con animales, los IBP suscitaron preocupación por la posibilidad de hipergastrinemia, pero los estudios en humanos no lograron mostrar una asociación.1 Por lo tanto, las consecuencias a largo plazo del uso crónico de IBP pueden agruparse en dos categorías principales, la malabsorción y las infecciones.1 La malabsorción secundaria al uso de IBP afecta al calcio y al magnesio, y la bibliografía especifica dos infecciones asociadas con mayor frecuencia al uso de IBP, Clostridium difficile y la neumonía. Desgraciadamente, en la literatura falta una definición de «largo plazo»; ni las directrices de la AGA ni las del ACG definen lo que se considera largo plazo. Para el resto de este artículo, los autores utilizan «a largo plazo» para designar la terapia de más de 14 días, la terapia máxima para los productos de venta libre.10,11
Malabsorción
La primera consecuencia potencial a largo plazo del uso crónico de IBP es la malabsorción de minerales clave en el organismo, concretamente el calcio y el magnesio. La pérdida de estos minerales podría provocar fracturas óseas o anomalías cardíacas.
Disminución de la absorción de calcio (hipocalcemia): El uso de IBP a largo plazo se ha asociado con un mayor riesgo de osteoporosis y una disminución de la densidad mineral ósea (DMO), con un aumento del 35% del riesgo de fracturas.14 El calcio desempeña un papel importante en la salud y la formación de los huesos, ya que es un componente clave de la hidroxiapatita (el principal elemento estructural del hueso). El material óseo es un importante depósito de calcio y puede contener más del 99% del calcio del organismo.15 La hipótesis del mecanismo de las fracturas óseas inducidas por los IBP es que la absorción del calcio en la dieta depende de un entorno ácido en el tracto gastrointestinal (GI). Debido a la disminución de la acidez por el efecto farmacológico de los IBP, se produce una pérdida potencial de absorción de calcio. Esta reducción de la absorción de calcio conduce a una disminución de la actividad osteoclástica y, por lo tanto, a una disminución de la DMO, lo que aumenta el riesgo de fractura.1
Las directrices del ACG de 2013 sobre la ERGE establecen que la osteoporosis existente no es una contraindicación para el tratamiento con IBP.13 Los pacientes con osteoporosis pueden seguir recibiendo tratamiento con IBP a menos que exista otro factor de riesgo de fractura de cadera.13 Además, en marzo de 2011, la FDA modificó su advertencia sobre la osteoporosis y las fracturas. Se concluyó que los productos de venta libre no justifican cambios en la etiqueta para incluir advertencias sobre el riesgo de fractura.16
Sin embargo, varios estudios han demostrado una asociación entre el uso de IBP a largo plazo y el riesgo de fracturas, pero contienen numerosos factores de confusión. Los factores de riesgo comunes para las fracturas, como un estilo de vida sedentario y el uso concomitante de ciertos medicamentos (por ejemplo, diuréticos tiazídicos, terapia de reemplazo hormonal, corticosteroides) se observan a menudo en pacientes que toman habitualmente IBP.14 Además, los pacientes que toman dosis altas de IBP tienen un mayor riesgo de fractura frente a los pacientes que toman dosis más bajas de venta libre.17 Por último, los pacientes que toman IBP durante periodos de tiempo prolongados (>1 año) tienen más probabilidades de sufrir una fractura.18
Un análisis de los datos obtenidos en el Estudio Multicéntrico Canadiense de Osteoporosis reveló que el uso de IBP se asoció con una menor DMO, especialmente en la cadera y el cuello femoral, en comparación con el uso de no IBP.19 Sin embargo, el uso de IBP a largo plazo no se asoció con un descenso acelerado de la DMO. Targownik et al. informaron de que los pacientes que utilizaban IBP tenían una DMO más baja; sin embargo, estos pacientes eran significativamente mayores (66,3 frente a 60,9 años; P <.001) y tenían un índice de masa corporal (IMC) medio más alto (28.3 frente a 26,9; P <.001).19
Los datos siguen siendo relativamente poco concluyentes y contradictorios en cuanto a la magnitud de la asociación entre los IBP y las fracturas en ausencia de factores de riesgo adicionales. Según las directrices del ACG de 2013, no hay pruebas suficientes que justifiquen la realización de pruebas rutinarias de DMO, la administración de suplementos de calcio u otras precauciones rutinarias debido al uso de IBP.13 Por el contrario, Health Canada emitió una alerta en abril de 2013 en la que afirmaba que los pacientes con factores de riesgo existentes para la osteoporosis deberían ser vigilados estrechamente y también deberían recibir un tratamiento con IBP a corto plazo en la dosis efectiva más baja.20 Esto es paralelo a las recomendaciones actuales de la FDA a pesar de la falta de recomendaciones del ACG.16 Si se indica la suplementación de calcio, el uso de citrato de calcio es el suplemento de calcio preferido en pacientes que toman IBP, ya que puede ser absorbido en ausencia de un entorno ácido.1
Disminución de la absorción de magnesio (hipomagnesemia): En marzo de 2011, la FDA publicó una advertencia relativa a los niveles bajos de magnesio sérico asociados al uso a largo plazo de los IBP.21 Un análisis de los informes del Sistema de Notificación de Eventos Adversos (AERS) de la FDA afirma que aproximadamente el 1% de los pacientes que experimentaron un efecto adverso mientras tomaban un IBP experimentaron hipomagnesemia.21 Se desconoce el mecanismo que subyace a los cambios en la absorción. Los síntomas de la hipomagnesemia incluyen convulsiones, arritmias, hipotensión y tetania. La hipomagnesemia también es potencialmente mortal.22 La hipomagnesemia relacionada con el uso crónico de IBP no se abordó en las directrices del ACG de 2013.13
Todos los IBP se asocian con una disminución de la absorción de magnesio.21 La hipomagnesemia fue más común en los pacientes de mayor edad que tomaban un IBP (edad media de 64,4 años).21 El tiempo medio hasta la aparición de la hipomagnesemia fue de 5,5 años después del inicio del tratamiento.21 Del mismo modo, una revisión sistemática de informes de casos descubrió que los pacientes que presentaban hipomagnesemia en asociación con el uso de IBP también presentaban otras alteraciones electrolíticas, concretamente hipopotasemia e hipocalcemia.23 La hipomagnesemia generalmente se resolvía con la interrupción del IBP y reaparecía poco después de volver a tomar el IBP.24
El uso simultáneo de medicamentos que también disminuyen el magnesio aumenta el riesgo de hipomagnesemia significativa. Danziger et al informaron de que los pacientes que toman un IBP con un diurético tienen un riesgo casi un 55% mayor de hipomagnesemia que los pacientes que sólo toman un IBP.22
Una Comunicación de Seguridad de Medicamentos de la FDA advierte de los riesgos de hipomagnesemia y recomienda que los proveedores controlen los niveles de magnesio sérico en los pacientes que toman IBP.21 La FDA sugiere que los proveedores obtengan los niveles de magnesio sérico antes de iniciar la terapia y periódicamente a partir de entonces para los pacientes que continuarán con un tratamiento prolongado y para los pacientes que toman medicamentos que también causan hipomagnesemia. Los pacientes que presentan una hipomagnesemia clínicamente significativa pueden requerir la interrupción del tratamiento con IBP, la reposición de magnesio mediante métodos orales o intravenosos y el tratamiento con una clase alternativa de medicamentos para las afecciones gastrointestinales, como un H2RA.1
Infecciones
Además de la disminución de la absorción de magnesio y calcio, los pacientes que toman IBP a largo plazo pueden tener un mayor riesgo de infección. La hipótesis del mecanismo de acción es que las secreciones ácidas gástricas actúan como mecanismo de defensa contra las bacterias entéricas, y el aumento del pH gástrico durante el uso de IBP permite la colonización de microbios oportunistas.1 Las directrices del ACG de 2013 advirtieron sobre el riesgo de aumento de las infecciones de C difficile y de la neumonía adquirida en la comunidad (NAC).13
Clostridium difficile: en un estudio retrospectivo de 2005, los investigadores encontraron que los pacientes que tomaban IBP tenían una razón de riesgo (HR) de 2,9 (IC 95%, 2,4-3,4); es decir, es decir, los pacientes tenían un riesgo 2,9 veces mayor de contraer C difficile que los pacientes que no tomaban un IBP.25 El 75% de los pacientes con casos notificados eran mayores de 65 años. No sólo el uso a largo plazo de IBP causa una mayor incidencia de C difficile, sino que los pacientes que recibieron un IBP durante el tratamiento de C difficile también tuvieron un 42% (IC del 95%, 1,11-1,82) más de probabilidades de tener una infección recurrente después de terminar la terapia.25
Un estudio de 2010 realizado por Linsky et al analizó la asociación del uso de IBP y C difficile recurrente.26 Los autores determinaron si el paciente tenía o no una infección por C difficile recurrente, entre 15 y 90 días después de la infección inicial por C difficile, si el paciente recibió un IBP en los 14 días siguientes a la infección inicial por C difficile. La HR para los pacientes expuestos a IBP durante el tratamiento fue de 1,42 (IC del 95%, 1,11-1,82). Para los pacientes mayores de 80 años, el HR aumenta de 1,42 a 1,86 (IC del 95%, 1,15-3,01).26
En 2012, la FDA emitió una declaración en la que detallaba la relación entre la diarrea asociada a C difficile (CDAD) con el uso de un IBP.27 La alerta de seguridad de la FDA advierte a los pacientes y a los profesionales sanitarios de que deben considerar la CDAD si un paciente toma un IBP y experimenta una diarrea persistente.27 La FDA también recomienda que los pacientes tomen la dosis más baja durante el periodo de tiempo más corto para tratar su condición actual.27 Las directrices del ACG de 2013 recomiendan el uso de IBP con precaución en pacientes con riesgo de infecciones por C difficile.13
Neumonía adquirida en la comunidad: Los pacientes que toman IBP pueden tener potencialmente un mayor riesgo de NAC. Sin embargo, el grado de asociación no está claro debido a los datos contradictorios.28-30 Las directrices del ACG de 2013 afirman que el uso de IBP a corto plazo puede aumentar el riesgo de NAC, pero el riesgo no parece ser elevado en el uso a largo plazo.13
Un estudio de cohortes de 2012 realizado por de Jagar et al mostró que los pacientes que tomaban IBP tenían 2,23 veces (IC del 95%, 1,28-3,75) más probabilidades de desarrollar una infección por NAC en comparación con los pacientes que no tomaban IBP.31 Lamentablemente, en el diseño del estudio no se incluyó la duración de la prescripción a los pacientes.31 En un metaanálisis realizado en 2004, los investigadores descubrieron que los pacientes que tomaban un agente supresor de la acidez, ya fuera un IBP o un ARH2, tenían 4,5 (IC del 95%, 3,8-5,1) veces más probabilidades de desarrollar una neumonía.30 La duración media de uso de los ARH2 fue de 2,8 meses; para los IBP la duración media fue de 5 meses.30
Por el contrario, un estudio de 2008 realizado por Sarkar et al mostró que el uso actual de IBP no se asoció con un mayor riesgo de NAC (odds ratio 1,02; IC del 95%: 0,97-1,08).29 Sin embargo, el estudio sí observó un mayor riesgo de adquirir una infección en los pacientes que habían iniciado el uso de un IBP en los últimos 14 días (OR ajustado 3,21; IC del 95%: 2,46-4,18).29
Los datos apoyan un aumento del riesgo de infecciones por neumonía a corto plazo, pero son contradictorios en cuanto a las consecuencias a largo plazo. A pesar de los datos contradictorios, es importante tener en cuenta este riesgo, especialmente debido a las nuevas regulaciones de los Centros para Medicare & Medicaid (CMS) sobre los reingresos hospitalarios.32 Laheij et al determinaron que la tasa de incidencia de neumonía era de 2,5 por cada 100 pacientes-año para los pacientes que tomaban IBP.30 Con 65,7 millones de prescripciones de omeprazol solamente y un aumento del coste de 15.682 dólares para los beneficiarios de Medicare debido a las hospitalizaciones por neumonía, el riesgo de infecciones asociadas al uso de IBP justifica la vigilancia y la medicina basada en la evidencia por parte del farmacéutico.33,34
Conclusión
Los IBP son una clase de fármacos eficaces y seguros. Ofrecen alivio a los pacientes en un sistema sanitario centrado en el paciente. Desafortunadamente, estos agentes tienen potencialmente algunas consecuencias a largo plazo por su uso continuado, incluyendo problemas de malabsorción y un mayor riesgo de infecciones. El farmacéutico puede ser un defensor del paciente en el sistema hospitalario o en la comunidad comprendiendo estos riesgos y fomentando la atención centrada en el paciente al empoderar a un paciente bien informado en las decisiones sanitarias.
1. Wolfe M. Visión general y comparación de los inhibidores de la bomba de protones para el tratamiento de los trastornos relacionados con la acidez. En: Basow DW, ed. UpToDate. Waltham, MA: UpToDate; 2013.
2. Top therapeutic classes by dispensed prescriptions (US). IMS Health. Actualizado el 22 de marzo de 2013. www.imshealth.com/deployedfiles/imshealth/Global/Content/Corporate/Press%20Room/2012_U.S/Top_Therapeutic_Classes_Dispensed_Prescriptions_2012.pdf. Consultado el 4 de noviembre de 2013.
3. Principales clases terapéuticas por gasto no descontado (Estados Unidos). IMS Health. Actualizado el 17 de febrero de 2013. www.imshealth.com/deployedfiles/imshealth/Global/Content/Corporate/Press%20Room/2012_U.S/Top_Therapeutic_Classes_by_Non-Discounted_Spending.U.S.pdf. Consultado el 4 de noviembre de 2013.
4. Dexlansoprazol. Lexi-Comp Online. Hudson, OH: Lexi-Comp, Inc. http://online.lexi.com. Consultado el 15 de agosto de 2013.
5. Esomeprazol. Lexi-Comp Online. Hudson, OH: Lexi-Comp, Inc. http://online.lexi.com. Consultado el 15 de agosto de 2013.
6. Lansoprazol. Lexi-Comp Online. Hudson, OH: Lexi-Comp, Inc. http://online.lexi.com. Consultado el 15 de agosto de 2013.
7. Omeprazol. Lexi-Comp Online. Hudson, OH: Lexi-Comp, Inc. http://online.lexi.com. Consultado el 15 de agosto de 2013.
8. Pantoprazol. Lexi-Comp Online. Hudson, OH: Lexi-Comp, Inc. http://online.lexi.com. Consultado el 15 de agosto de 2013.
9. Rabeprazol. Lexi-Comp Online. Hudson, OH: Lexi-Comp, Inc. http://online.lexi.com. Consultado el 15 de agosto de 2013.
10. Información sobre Prilosec OTC (omeprazol). FDA. September 21, 2010. www.fda.gov/AboutFDA/CentersOffices/OfficeofMedicalProductsandTobacco/CDER/ucm220944.htm. Consultado el 5 de junio de 2013.
11. Novartis lanza Prevacid 24HR de venta libre para un verdadero alivio de la acidez estomacal frecuente durante 24 horas. Comunicados de prensa de Novartis. 12 de noviembre de 2009. https://www.prevacid24hr.com/news-press-releases.html. Consultado el 5 de junio de 2013.
12. Kahrilas PJ, Shaheen NJ, Vaezi MF, et al. Revisión técnica del Instituto de la Asociación Americana de Gastroenterología sobre el manejo de la enfermedad por reflujo gastroesofágico. Gastroenterology. 2008;135:1392-1413.
13. Katz P, Gerson L, Vela, M. Guidelines for the diagnosis and management of gastroesophageal reflux disease. Am J Gastroenterol. 2013;108:308-328.
14. Khalili H, Huang ES, Jacobson BC, et al. Uso de inhibidores de la bomba de protones y riesgo de fractura de cadera en relación con factores dietéticos y de estilo de vida: un estudio de cohorte prospectivo. BMJ. 2012;344:e372.
15. Flynn A. El papel del calcio dietético en la salud ósea. Proc Nutr Soc. 2003;62:851-858.
16. Comunicación de seguridad de medicamentos de la FDA: Posible aumento del riesgo de fracturas de cadera, muñeca y columna vertebral con el uso de inhibidores de la bomba de protones. FDA. March 28, 2011. www.fda.gov/drugs/drugsafety/postmarketdrugsafetyinformationforpatientsandproviders/ucm213206.htm. Consultado el 11 de junio de 2013.
17. Yang YX, Lewis JD, Epstein S, Metz DC. Terapia a largo plazo con inhibidores de la bomba de protones y riesgo de fractura de cadera. JAMA. 2006;296:2947-2953.
18. Targownik LE, Lix LM, Metge CJ, et al. Uso de inhibidores de la bomba de protones y riesgo de fracturas relacionadas con la osteoporosis. CMAJ. 2008;179:319-326.
19. Targownik LE, Leslie WE, Davison KS, et al. La relación entre el uso de inhibidores de la bomba de protones y el cambio longitudinal en la densidad mineral ósea: un estudio basado en la población del Canadian Multicentre Osteoporosis Study (CaMos). Am J Gastroenterol. 2012;107:1361-1369.
20. Inhibidores de la bomba de protones: riesgo de fracturas óseas. Health Canada. 4 de abril de 2013. http://healthycanadians.gc.ca/recall-alert-rappel-avis/hc-sc/2013/26523a-eng.php. Consultado el 27 de agosto de 2013.
21. Comunicación de seguridad de medicamentos de la FDA: Los niveles bajos de magnesio pueden estar asociados al uso a largo plazo de medicamentos inhibidores de la bomba de protones (IBP). FDA. 14 de marzo de 2011. www.fda.gov/drugs/drugsafety/ucm245011.htm. Consultado el 11 de junio de 2013.
22. Danziger J, William JH, Scott DJ, et al. El uso de inhibidores de la bomba de protones se asocia con bajas concentraciones de magnesio en suero. Kidney Int. 2013;83:692-699.
23. Luk CP, Parsons R, Lee YP, Hughes JD. Hipomagnesemia asociada a inhibidores de la bomba de protones: ¿qué nos dicen los datos de la FDA? Ann Pharmacother. 2013;47:773-780.
24. Hess MW, Hoenderop JG, Bindels RJ, Drenth JP. Revisión sistemática: hipomagnesemia inducida por la inhibición de la bomba de protones. Aliment Pharmacol Ther. 2012;36:405-413.
25. Dial S, Delaney JA, Barkun AN, Suissa S. Uso de agentes supresores de ácido gástrico y el riesgo de enfermedad asociada a Clostridium difficile adquirida en la comunidad. JAMA. 2005;294:2989-2995.
26. Linsky A, Gupta K, Lawler EV, et al. Proton pump inhibitors and risk for recurrent Clostridium difficile infection. Arch Intern Med. 2010;170:772-778.
27. Inhibidores de la bomba de protones (IBP)-comunicación de seguridad de medicamentos: La diarrea asociada a Clostridium difficile (CDAD) puede estar asociada a los fármacos contra la acidez de estómago. FDA. www.fda.gov/safety/medwatch/safetyinformation/safetyalertsforhumanmedicalproducts/ucm290838.htm. Consultado el 5 de junio de 2013.
28. Gulmez SE, Holm A, Frederiksen H, et al. Uso de inhibidores de la bomba de protones y el riesgo de neumonía adquirida en la comunidad: un estudio de casos y controles basado en la población. Arch Intern Med. 2007;167:950-955.
29. Sarkar M, Hennessy S, Yang YX. Proton-pump inhibitor use and the risk for community-acquired pneumonia. Ann Intern Med. 2008;149:391-398.
30. Laheij RJ, Sturkenboom MC, Hassing RJ, et al. Risk of community-acquired pneumonia and use of gastric acid-suppressive drugs. JAMA. 2004;292:1955-1960.
31. de Jager CP, Wever PC, Gemen EF, et al. El tratamiento con inhibidores de la bomba de protones predispone a la neumonía por Streptococcus pneumoniae adquirida en la comunidad. Aliment Pharmacol Ther. 2012;36:941-949.
32. Rau J. Medicare penalizará a 2.217 hospitales por exceso de readmisiones. Kaiser Health News. 13 de agosto de 2012. www.kaiserhealthnews.org/Stories/2012/August/13/medicare-hospitals-readmissions-penalties.aspx. Consultado el 1 de septiembre de 2012.
33. Los 25 principales medicamentos por prescripciones dispensadas (Estados Unidos). IMS Health. Actualizado el 22 de marzo de 2013. www.imshealth.com/deployedfiles/imshealth/Global/Content/Corporate/Press%20Room/2012_U.S/Top_25_Medicines_Dispensed_Prescriptions_U.S.pdf. Consultado el 4 de noviembre de 2013.
34. Thomas CP, Ryan M, Chapman JD, et al. Incidencia y coste de la neumonía en los beneficiarios de Medicare. Chest. 2012;142:973-981.
Para comentar este artículo, contacte con [email protected].