Es posible que hayas oído hablar del compuesto químico que carece de enlaces C-H. Tales compuestos se conocen como «compuestos inorgánicos» ya que no son los orgánicos por carecer de Carbono. El trifluoruro de boro es un compuesto inorgánico y su fórmula es BF3. No contiene ningún color y es un gas tóxico. Crea humos blancos en el aire húmedo. Si se encuentra en forma de líquido incoloro, es muy soluble (dihidrato.)
Contenidos
Geometría Molecular del BF3
La geometría de la molécula del BF3 es ‘Trigonal Planar’. Con la referencia de la Química, ‘Trigonal Planar’ es un modelo con tres átomos alrededor de un átomo en el centro. Es como átomos periféricos todos en un plano, ya que los tres son similares con los ángulos de enlace de 120° en cada uno que los hace un triángulo equilátero.
Estructura de Lewis del BF3

Para conocer la estructura de Lewis del BF3, tenemos que calcular el número total de electrones de valencia de la molécula de BF3. El BF3 tiene un total de 24 electrones de valencia, que tenemos que poner alrededor del átomo central. Antes de completar los octetos, no olvides determinar cuántos electrones de valencia hay en el trifluoruro de boro y colocarlos en consecuencia.
El boro estará en el centro de la estructura por ser el menos electronegativo. Necesita seis electrones de valencia en su capa exterior. Si comprobamos las cargas formales de la estructura de Lewis del trifluoruro de boro, encontraremos que son cero a pesar de que el boro sólo tenía seis electrones de valencia.
¿Cómo dibujar la estructura de Lewis del BF3?
Para dibujar una estructura de Lewis, lo primero es añadir electrones y dibujar las conectividades. Como se ha comentado, aquí hay 24 electrones. Después, añade octetos al átomo exterior y electrones extra al átomo central. Pero, como sabemos, no hay electrones extra. (24 – 24 = 0)
Violaciones
Una cosa a tener en cuenta al dibujar la estructura de Lewis es que la Regla del Octeto puede ser violada en estas tres situaciones; pero, no necesitamos pensar en ello cada vez ya que es raro y estas excepciones sólo se darán cuando sea necesario.
Excepción 1: Si hay un número impar de electrones de valencia como 3,5,7, etc.
Excepción 2: Si hay muy pocos electrones de valencia
Excepción 3: Si hay demasiados electrones de valencia
Aquí, en este caso, el electrón central no tiene ningún octeto ya que tiene seis partículas. Así que, ¡intenta añadir más de un enlace para decidir si el átomo central puede conseguir un octeto o no!
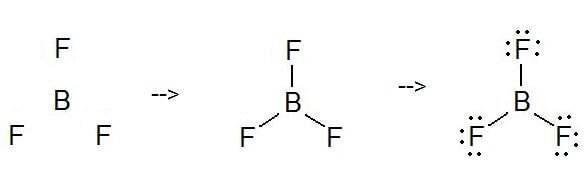
Como puedes ver, ahora tiene un octeto.
Hibridación de BF3
La hibridación consiste en mezclar orbitales atómicos en nuevos orbitales híbridos. Se acomodan para explicar la geometría molecular y las propiedades del enlace nuclear. Hay varios tipos de hibridación como SP3, SP2, SP. El BF3 es una hibridación SP2. Para esta molécula, es SP2 porque se requiere un enlace π (pi) para el doble enlace entre el Boro y sólo se forman tres enlaces σ por átomo de Boro. Los orbitales S atómicos y los orbitales P en la capa exterior del Boro se mezclan para formar tres orbitales híbridos SP2 equivalentes.
Polaridad del BF3
La polaridad representa una separación de carga eléctrica que lleva a que una molécula o sus grupos tengan un momento eléctrico dipolar o multipolar. Si hablamos de contradicción, entonces la respuesta es ¡NO! El BF3 es no polar. Cuando la diferencia de electronegatividad entre los dos átomos es inferior a 0,5, es mayoritariamente no polar.

Espero que este artículo haya tenido sentido para ti y te haya ayudado a entender la estructura de Lewis del BF3, la geometría molecular, la hibridación y la polaridad. Sigue atento para saber más sobre las diferentes fórmulas y otras cosas importantes relacionadas con tu querida química.