Todos nós sabemos muito bem o que é calor e o que é capaz de fazer. Mas, o calor específico é um conceito que muito poucas pessoas conhecem. Além disso, utilizamos calor específico para elevar a temperatura de um objecto em grau. Além disso, vamos discutir calor específico, fórmula de calor específico, a sua derivação e exemplos resolvidos neste tópico. Além disso, o calor específico de diferentes elementos difere um do outro.
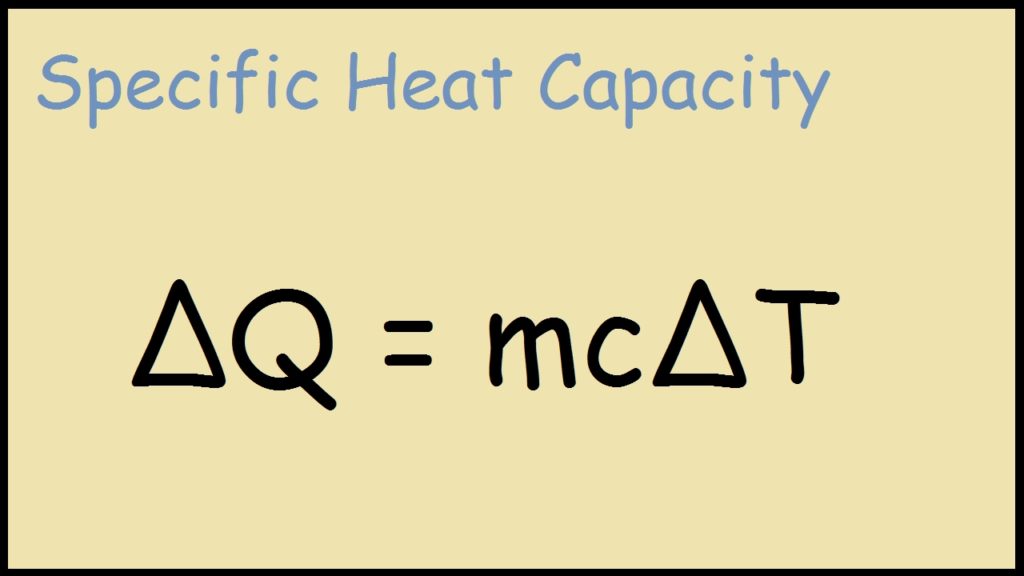
Fonte: YouTube
Calor específico
Calor específico refere-se à razão da quantidade de calor que necessitamos para elevar a temperatura de um corpo em um grau que necessitamos para aumentar a temperatura de uma massa equivalente de líquido (água) em um grau. Também usamos o termo num sentido mais restrito para significar a quantidade de calor, em calorias que necessitamos para aumentar a temperatura de um grama de uma substância em um grau Celsius.
Em palavras simples, é a razão da quantidade de calor necessária para aumentar a temperatura de um objecto em um grau para a quantidade de calor necessária para aumentar a temperatura da mesma quantidade de água em um grau.
Encontre aqui a enorme lista de Fórmulas Físicas
Fórmula de Calor Específico
Como discutimos acima, o calor específico é a relação de mudança de temperatura de um objecto com água.
A fórmula também é assim:
Energia térmica = (massa do objecto ou substância) × (calor específico) × (mudança de temperatura)
Q = m × c × \(\Delta T\)
Or
Q = \(mc\Delta T\)
Derivação de Fórmula de Calor Específico
Exemplos resolvidos de Fórmula de Calor Específico
Exemplo 1
Se o calor específico do ouro for 129 \(J/kg\cdot k\). Então que quantidade de energia térmica é necessária para elevar a temperatura de 100 g de ouro em 50,0 K?
p>Solução:p>Cálculo:p>p>Q = \(mc\Delta T\)
Q = (0,100 kg) (129 \ \(J/kg\cdot k\)) (50,0 K)
Então, a energia necessária para elevar a temperatura de 100 g de ouro é 645 J.
Exemplo 2
Suponha que um pote é aquecido transferindo 1676 KJ de energia térmica para a água. Além disso, se houver 5.000 kg de água no pote e a temperatura for aumentada em 80,0 K, então encontrar o calor específico da água?
Solução:
P>Vamos anotar as coisas dadas na pergunta
Massa (m) = 5,00 kg
Temperatura (T) = 80.0 K
Calor específico (c) = 1676 KJ
Agora temos de converter o calor específico em Joules porque está em Kilojoules.
Então, a conversão é assim
1 KJ = 1,000 J
Então, 1676 KJ = 1,000 × 1676 = 16,76,000 J
Agora ponha todos os valores na fórmula. Mas, antes disso, temos de reorganizar a fórmula para encontrar calor específico.
Q = {mc\Delta T\) c = {mfrac{Q}{mDelta T})
p>P>Agora a colocar valores na fórmula reorganizada
C = {mfrac{1676000} {(5.00 kg)(80.0)})
C = 4190 \\(J/kg\cdot k\)
Hence, o calor específico da água é 4190 \(J/kg\cdot k\).