US Pharm. 2020;45(6):30-32.
ABSTRACT: A FDA define um medicamento genérico como um “medicamento criado para ser o mesmo que um medicamento de marca já comercializado na forma de dosagem, segurança, força, via de administração, qualidade, características de desempenho, e utilização pretendida”. O sistema de saúde dos EUA poupou quase 2 biliões de dólares de 2009 a 2019 em custos de saúde devido ao uso genérico, com poupanças crescentes todos os anos. Apesar desta variação nos custos, barreiras como a falta de comunicação e educação, efeitos secundários anteriores, ou preferência podem desempenhar um papel na utilização contínua de medicamentos de marca. O aumento do mercado de produtos genéricos criará concorrência e, em última análise, conduzirá a preços mais baixos de medicamentos e ao acesso a cuidados de saúde acessíveis para mais pacientes. É importante que os farmacêuticos educem os pacientes e fornecedores sobre o uso adequado de medicamentos genéricos versus medicamentos de marca.
A FDA define um medicamento genérico como um “medicamento criado para ser o mesmo que um medicamento de marca já comercializado na forma de dosagem, segurança, força, via de administração, qualidade, características de desempenho, e utilização pretendida “1,2 Os medicamentos genéricos, portanto, são equivalentes aos produtos de marca em termos de eficácia, qualidade, e segurança. As Aplicações Abreviadas de Novos Medicamentos (ANDAs) para aprovações genéricas devem demonstrar bioequivalência e que o ingrediente activo é o mesmo que o nome da marca; podem diferir com base nos ingredientes inactivos, mas estas diferenças devem ser comprovadas como não tendo qualquer efeito sobre o funcionamento do medicamento.1-3
A Lei de 1984 da Concorrência de Preços de Medicamentos e Restauração do Prazo de Patentes, ou Lei Hatch-Waxman, permitiu que os genéricos fossem aprovados para utilização no mercado sem testes pré-clínicos e clínicos para assegurar que um genérico seria mais barato em comparação com o seu produto de marca equivalente. Os genéricos variam entre 80% e 85% mais baratos quando comparados com o seu produto de marca.1 De acordo com os dados da IQVIA 2019, o sistema de saúde dos EUA poupou quase 2 biliões de dólares entre 2009 e 2019 devido ao uso de genéricos, com poupanças crescentes todos os anos.4,5 De acordo com um relatório da Associação de Medicamentos Acessíveis (AAM), 4 biliões de prescrições genéricas foram preenchidas em 2018 nos EUA, que representaram 90% das receitas médicas preenchidas nos EUA. No entanto, isto representou apenas 22% de todos os gastos com medicamentos.5
Devido às percepções ou experiências passadas com medicamentos genéricos, alguns consumidores continuam a utilizar medicamentos de marca apesar desta diferença de custo, o que pode levar a um aumento dos gastos dos consumidores, insatisfação dos pacientes e, em última análise, a uma diminuição da adesão. Responder a perguntas ou discutir o uso de medicamentos genéricos versus medicamentos de marca ou inativos versus ingredientes ativos com os pacientes é um papel importante para os farmacêuticos para ajudar a melhorar a satisfação dos pacientes, a adesão e a qualidade de vida. Ter um maior mercado de produtos genéricos irá criar concorrência e, em última análise, conduzir a preços mais baixos de medicamentos e acesso a cuidados de saúde acessíveis para mais pacientes.1
Pontos de Discussão
Devido a concepções erradas e falta de compreensão da diferença entre produtos de marca e genéricos, educar os pacientes sobre os factos é vital. Os próximos parágrafos são conceitos de discussão que podem ser importantes para os nossos pacientes.
Qual é a diferença entre ingredientes activos e inactivos?
Um ingrediente activo é o componente do medicamento que produz o efeito farmacológico no organismo. Os princípios activos podem sofrer alterações químicas à medida que o produto foi fabricado e estar presente de uma forma modificada para que produza o seu efeito.6 Um exemplo disto seria uma formulação de libertação prolongada de um medicamento. Um ingrediente inactivo é um componente do medicamento que não afecta a acção terapêutica do medicamento sobre o corpo. Os ingredientes inactivos são adicionados a um medicamento para ajudar na sua ligação, aromatização, coloração, conservação, ou transporte do medicamento. Exemplos seleccionados de ingredientes inactivos são álcool, gelatina, galactose, lactose e sacarina.
p> Para obter a aprovação da FDA, um medicamento genérico deve conter o mesmo ingrediente activo que o medicamento de origem (ou seja, produto de marca). Embora os ingredientes inactivos possam ser diferentes, a FDA efectua regularmente extensas revisões dos produtos genéricos para garantir que estes cumprem as normas. A FDA compreende que pode haver variabilidade em cada lote fabricado, mas a quantidade de variabilidade é limitada. Esta variabilidade pode ocorrer entre medicamentos de marca e genéricos, mas também pode ocorrer entre marcas, devido a ligeiras diferenças no fabrico de lotes.1 A FDA também investiga os efeitos secundários relatados com uma marca ou produto genérico para determinar se são necessárias alterações no fabrico.
Qual é a diferença entre um produto genérico e um genérico autorizado?
Um produto genérico é o equivalente a um produto de marca fabricado por uma empresa separada da empresa que fabrica o produto de marca. Um genérico autorizado, contudo, pode ser comercializado pela empresa de medicamentos de marca ou pela empresa com a permissão da marca, mas como genérico a um custo inferior. Os genéricos autorizados são os mesmos que o medicamento de marca na medida em que têm os mesmos ingredientes activos e inactivos, mas a sua aparência pode ser diferente.7 Um genérico autorizado não pode ser incluído na lista de medicamentos genéricos da FDA, conhecida como o Livro Laranja, uma vez que é comercializado sob o Novo Pedido de Medicamento da marca versus produtos genéricos, que são aprovados após a apresentação de um ANDA.7,8
Os genéricos e genéricos autorizados podem ter um custo inferior quando comparados com os medicamentos de marca, uma vez que os fabricantes de genéricos não têm de completar os ensaios clínicos que eram necessários para os produtos de marca.
Is There Anything to Look Out When Switching From a Brand to a Generic Product?
Medicamentos genéricos e de marca não podem ter a mesma aparência, devido às leis de marca nos EUA. As diferenças de cor, forma, tamanho e sabor, contudo, não desempenham um papel na forma como os medicamentos funcionam. Como anteriormente referido, a variabilidade ocorre em lotes, mas a níveis muito pequenos e não significativos. Por exemplo, um grande estudo comparando genéricos com medicamentos de marca encontrou pequenas diferenças de apenas 3,5% na absorção no corpo entre genéricos e medicamentos de marca.9
Barreiras Possíveis à Prescrição de Genérico e Formas de Superar
Survas e estudos têm sido realizados ao longo dos anos para analisar as barreiras no uso de genéricos ou o aumento de trocas de genérico para marca. A TABELA 1 fornece uma lista de possíveis barreiras à prescrição e distribuição de genéricos.10-15
 br>>
br>>
Um inquérito conduzido em pacientes epilépticos e as suas preocupações com substituições genéricas concluíram que os pacientes acreditavam que as alterações só deveriam ser determinadas pelo fornecedor ou pelo paciente. Estas preocupações decorrem das preocupações dos prestadores de serviços com as apreensões de crises revolucionárias ao mudar ou com o aumento do risco de efeitos secundários e das preocupações dos pacientes de que os genéricos podem não proporcionar uma eficácia ou tolerabilidade equivalente.16 No entanto, foi também demonstrado que ter uma relação com o farmacêutico e tornar o prestador e os pacientes conscientes das mudanças de fabricante pode ajudar a melhorar a utilização de genéricos em pacientes epilépticos.17
Além disso, alguns clínicos e cientistas expressaram preocupações sobre a aprovação da bioequivalência da FDA. Contudo, o Therapeutic Inequivalence Action Coordinating Committee, um grupo de análise pós-comercialização da FDA, identifica e avalia relatórios de falhas terapêuticas para determinar se é necessária a remoção de produtos não equivalentes.9 Além disso, estudos concluíram que os testes de bioequivalência exigidos pela FDA são robustos e ajudam a apoiar a aprovação de que a marca e os genéricos são equivalentes terapêuticos.9
Estudos reviram as taxas de mudança ou a quantidade de vezes que os pacientes mudam de novo para medicamentos de marca de genéricos apesar de um diferencial de custos. Estudos que reviram os genéricos e genéricos autorizados mostraram uma taxa mais baixa de “switchbacks” de marca devido a intervenções para melhorar a comunicação e educação sobre a equivalência de genéricos e produtos de marca.11,12 Além disso, as semelhanças na aparência também impediram “switchbacks” de marca.11
Devem ser feitas recolhas recentes de produtos genéricos, os pacientes também podem ficar apreensivos para mudar para genéricos, uma vez que podem não ser produzidos nos EUA, acreditando que os medicamentos fabricados fora dos EUA não são seguros, apesar da aprovação da FDA. Uma educação adequada sobre os detalhes das retiradas é eficaz para encorajar a adesão aos medicamentos.14
Embora esteja disponível um medicamento genérico, a utilização de um produto de marca pode ser clinicamente apropriada em situações seleccionadas. Por exemplo, pacientes anteriores que tomaram medicamentos epilépticos e que experimentaram um aumento na frequência das crises com uma mudança genérica podem ser apropriados para uma mudança para um medicamento de marca para controlo das crises.15
Com as várias barreiras discutidas acima, vários estudos demonstraram que a promoção de intervenções educativas para pacientes e fornecedores pode ajudar a aumentar a confiança no uso genérico.13 Além disso, a educação sobre o uso genérico pode ajudar a melhorar a qualidade dos cuidados e a aderência aos medicamentos. O relatório da AAM de 2019 analisou as taxas de abandono dos medicamentos, examinando a taxa a que os pacientes não podem tomar ou recolher os seus medicamentos apesar de solicitarem a prescrição. O relatório conclui que as taxas de abandono de novos pacientes são 266% mais elevadas para medicamentos de marca quando comparadas com medicamentos genéricos.5 Os co-pagamentos desempenharam um papel significativo nesta taxa de abandono; 90% dos co-pagamentos genéricos foram inferiores a $20 em comparação com os 39% dos medicamentos de marca.5
RecURSOS DISPONÍVEIS PARA ASSISTÊNCIA COM EDUCAÇÃO
Múltiplos recursos estão disponíveis para ajudar a compreender e discutir os medicamentos de marca e genéricos. Consulte a TABELA 2 para uma visão geral de recursos disponíveis úteis seleccionados.
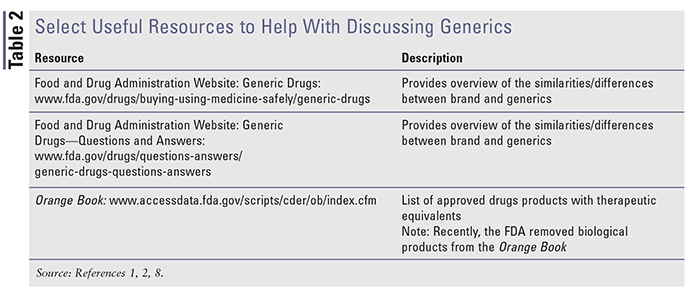
>/p>
CONCLUSÃO
Como farmacêuticos, estabelecemos um juramento de aplicar os nossos conhecimentos para assegurar resultados óptimos aos nossos pacientes e advogar mudanças que melhorem os cuidados prestados aos pacientes. Melhorar a adesão, educar os nossos pacientes sobre os factos, e ter uma comunicação aberta com os fornecedores de informação é vital para cumprirmos o nosso juramento como farmacêuticos. A FDA completa um processo rigoroso de aprovação de medicamentos genéricos no mercado dos EUA; contudo, devido a percepções ou quantidade de informação viável, os pacientes podem ficar apreensivos para tomar medicamentos genéricos. Estudos provaram que ultrapassar barreiras e educar pacientes e fornecedores sobre factos de genérico versus marca pode ajudar a melhorar a prescrição de genéricos e, em última análise, ajudar a produzir cuidados de saúde acessíveis.
1. FDA. Medicamentos genéricos. www.fda.gov/drugs/buying-using-medicine-safely/generic-drugs. Acedido a 19 de Março de 2020.
2. FDA. Medicamentos genéricos: perguntas e respostas. www.fda.gov/drugs/questions-answers/generic-drugs-questions-answers. Acesso 19 de Março de 2020.
3. Dunne S, Shannon B, Dunne C, Cullen W. Uma revisão das diferenças e semelhanças entre os medicamentos genéricos e os seus equivalentes originais, incluindo os benefícios económicos associados à utilização de medicamentos genéricos, utilizando a Irlanda como um estudo de caso. BMC Pharmacol Toxicol. 2013;14:1.
4. IQVIA Institute for Human Data Science. Global medicine spending and usage trends: outlook 2024. www.iqvia.com/-/media/iqvia/pdfs/institute-reports/global-medicine-spending-and-usage-trends.pdf?_=1586623006517. Acedido a 20 de Março de 2020.
5. Associação para Medicamentos Acessível. O caso da concorrência: 2019 acesso e poupança de medicamentos genéricos e biosimilares no relatório dos EUA. https://accessiblemeds.org/sites/default/files/2019-09/AAM-2019-Generic-Biosimilars-Access-and-Savings-US-Report-WEB.pdf. Acesso 20 de Março de 2020.
6. FDA. Aprovações de medicamentos e bases de dados: ingrediente inactivo. www.fda.gov/drugs/drug-approvals-and-databases/inactive-ingredient-search-approved-drug-products-frequently-asked-questions. Acedido a 20 de Março de 2020.
7. FDA. Abreviatura de Nova Aplicação de Medicamentos (ANDA): Lista da FDA de medicamentos genéricos autorizados. www.fda.gov/drugs/abbreviated-new-drug-application-anda/fda-list-authorized-generic-drugs. Acedido a 21 de Março de 2020.
8. FDA: Livro Laranja: produtos medicamentosos aprovados com avaliações de equivalência terapêutica. www.accessdata.fda.gov/scripts/cder/ob/index.cfm. Acedido a 21 de Março de 2020.
9. Davit BM, Nwakama PE, Buehler GJ, et al. Comparação de medicamentos genéricos e inovadores: uma revisão de 12 anos de dados de bioequivalência da Food and Drug Administration dos Estados Unidos. Ann Pharmacother. 2009;43(10):1583-1597.
10. Choudhry NK, Denberg D, Qaseem A. Melhorar a aderência à terapia e aos resultados clínicos, contendo simultaneamente os custos: oportunidades decorrentes de uma maior utilização de medicamentos genéricos: conselhos de melhores práticas do Comité de Directrizes Clínicas do Colégio Americano de Médicos. Ann Intern Med. 2016;164:41-49.
11. Desai RJ, Sarpatwari A, Dejene S, et al. Diff
12. Hansen RA, Qian J, Berg R, et al. Comparação das taxas de troca de genérico por marca entre medicamentos genéricos e genéricos autorizados. Farmacoterapia. 2017;37(4):429-437.
13. Desai RJ, Sarpatwari A, Dejene S, et al. Eficácia comparativa do uso de medicamentos genéricos e de marca: um estudo de base de dados de reclamações de seguros de saúde dos EUA. PLoS Med. 2019;16(3):e1002763.
14. FDA. O que saber e fazer sobre possíveis nitrosaminas na sua medicação. www.fda.gov/consumers/consumer-updates/what-know-and-do-about-possible-nitrosamines-your-medication. Acedido a 13 de Maio de 2020.
15. Straka RJ, Keohane DJ, Liu LZ. Potencial impacto clínico e económico da mudança de medicamentos de marca para genéricos. Am J Ther. 2017;24(3):e278-e289.
16. Ngo SNT, Stupans I, McKinnon RA. Substituição genérica no tratamento da epilepsia: atitudes e percepções do paciente. Comportamento da epilepsia. 2013;26:64-66.
17. Greb E. Estudo revela preocupações sobre a mudança de medicamentos antiepilépticos de marca para genéricos. Neurologia Rev. 2014;22(3):6.
p> O conteúdo contido neste artigo é apenas para fins informativos. O conteúdo não pretende ser um substituto para aconselhamento profissional. A confiança em qualquer informação fornecida neste artigo é apenas por sua conta e risco.