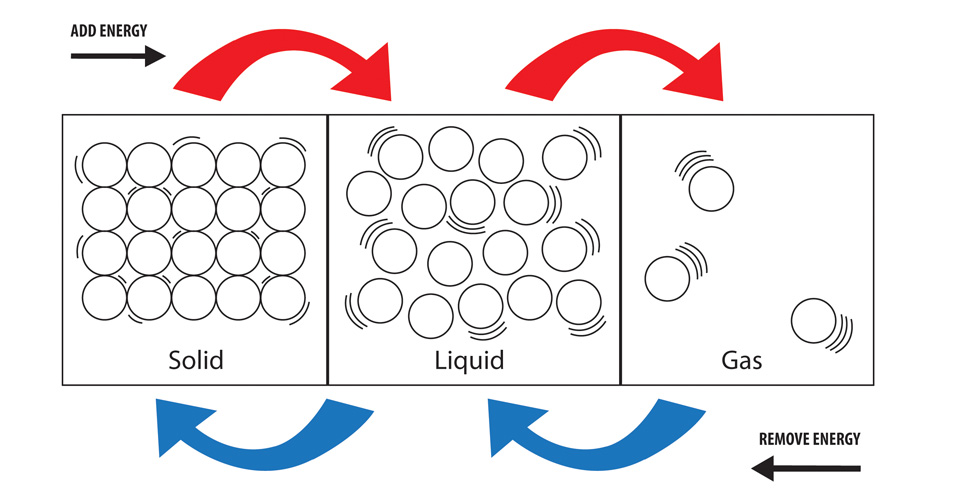
In un solido le particelle hanno la più bassa quantità di energia rispetto a quelle in uno stato liquido e in uno stato gassoso (la più alta quantità di energia dei tre stati). I legami richiedono energia per rompersi e rilasciano energia quando si formano. Per formare un liquido da un solido, dobbiamo rompere dei legami e per formare un gas da un liquido dobbiamo rompere ancora più legami. Questo richiede un maggiore apporto di energia ogni volta che si rompono più legami.
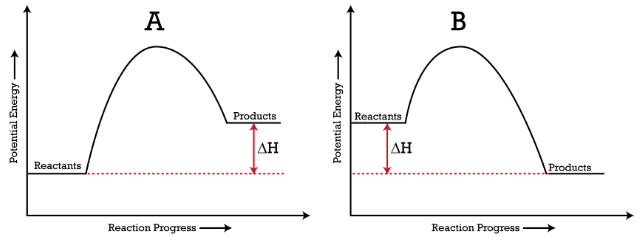
Processi endotermici (grafico A) sono quelli in cui l’energia viene assorbita da un sistema/reagenti e l’energia delle particelle coinvolte è maggiore di quella precedente al processo.
I processi esotermici ( grafico B ) sono l’opposto dei processi endotermici – l’energia viene rilasciata da un sistema / reagenti e le particelle coinvolte hanno un’energia inferiore dopo il processo rispetto a prima.
Collegando questo allo stato solido, liquido e gassoso, quando si vaporizza una sostanza (trasformandola in un gas) si stanno promuovendo le particelle della sostanza ad uno stato in cui possiederanno più energia. Questa energia deve ‘venire’ da qualche parte e quindi l’energia viene presa dai dintorni del processo. Con i cambiamenti di stato, questo è di solito sotto forma di calore (sebbene anche la pressione possa essere presa in considerazione).
La condensazione è un gas che si trasforma in un liquido e quindi uno ‘stato’ di particelle ad alta energia che diventa uno ‘stato’ di particelle a bassa energia. Se l’energia complessiva delle particelle coinvolte è inferiore a quella precedente al processo, l’energia deve essere stata rilasciata e quindi il processo può essere considerato esotermico.