L’ozono è uno degli esempi più comuni usati per studiare la struttura di Lewis. La molecola di ozono ha tre atomi di ossigeno. Si scrive come O3 nelle equazioni di chimica di base. Per capire l’ibridazione, la polarità e la geometria molecolare della molecola di ozono è fondamentale conoscere la struttura di Lewis della stessa.
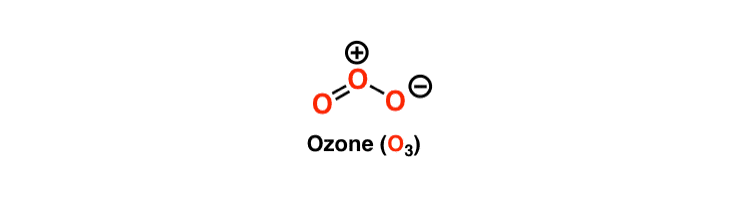
| Nome della molecola | Ozono (O3) |
| Numero di elettroni di valenza nella molecola | 18 |
| Ibridazione di O3 | Ibridizzazione SP2 |
| Angoli di legame | 116 gradi |
| Geometria Molecolare di O3 | Curva |
Ora, molte persone chiedono perché è necessario conoscere la struttura di Lewis di qualsiasi molecola o composto. La risposta a questa domanda è semplice; questa struttura aiuta a capire la struttura di base, gli elettroni che prendono parte alla formazione dei legami insieme alle cariche su un dato atomo. La regola dell’ottetto afferma che ci dovrebbero essere otto elettroni nel guscio esterno o nell’orbita dell’atomo perché la molecola sia stabile. La struttura di Lewis aiuta a conoscere il numero di elettroni di valenza nella molecola. Gli elettroni di valenza sono gli elettroni che partecipano alla formazione del legame e le coppie di elettroni non leganti.
Gli elettroni che partecipano alla formazione del legame sono noti come coppie di elettroni leganti. Questi elettroni sono rappresentati disegnando delle linee nella struttura di Lewis. Mentre gli elettroni che non prendono parte alla formazione del legame sono coppie di elettroni non leganti. I punti intorno all’atomo centrale rappresentano questi elettroni.
Contenuti
Elettroni di valenza O3
Nell’ozono o O3, ci sono sei elettroni di valenza per ogni molecola di ossigeno.
Qui, poiché ci sono tre molecole di ossigeno, il numero totale di elettroni di valenza è 6*3= 18.
Quindi ci sono un totale di 18 elettroni di valenza disponibili per la molecola di ozono.
Struttura di Lewis dell’O3
Come la regola dell’ottetto si applica in questa struttura, l’atomo centrale è il primo che dovrebbe avere otto elettroni nel suo guscio esterno. Quindi una molecola di ossigeno è al centro e le altre due sono ai lati opposti.
L’atomo centrale ha una coppia solitaria di elettroni ed è stabile grazie agli otto elettroni nella sua orbita più esterna. Per soddisfare la regola dell’ottetto, un atomo centrale deve formare un doppio legame su uno dei suoi lati con una molecola di ossigeno e un altro legame singolo. Poiché entrambe le molecole di ossigeno hanno la stessa elettronegatività e struttura, il doppio legame continua a spostarsi da entrambe le molecole.


Strutture di risonanza di O3
Tuttavia, la struttura dell’ozono è unica perché l’atomo centrale ha un doppio legame e un legame singolo con le molecole di ossigeno vicine. Questi legami continuano a scambiarsi di posto, e quindi l’ozono ha una struttura di risonanza di Lewis. La risonanza significa il costante interscambio dei legami tra le tre molecole dell’ozono. L’atomo centrale nella struttura di Lewis avrà una carica di +1 e l’atomo che forma un singolo legame avrà una carica di -1.


Ibridazione O3
Ibridizzazione in chimica significa l’ibridazione di due o più livelli atomici di energie uguali o diverse per combinarsi e dare un nuovo orbitale. Una volta che conosciamo la struttura di Lewis di una molecola, è facile conoscerne l’ibridazione. Poiché l’ozono ha un atomo di ossigeno centrale che ha otto elettroni nel suo guscio più esterno, l’ibridazione per l’atomo centrale sarà sp2. Ci sono due elettroni nell’orbitale 2s, mentre 6 elettroni in entrambi gli orbitali 2p su tre orbitali 2p. Poiché ci sono elettroni in un orbitale s e due orbitali p, l’ibridazione dell’atomo di ossigeno centrale diventa sp2.
Anche altri due atomi di ossigeno hanno ibridazione. Uno avrà ibridazione sp2, mentre l’altro avrà ibridazione sp3 perché c’è una coppia solitaria di elettroni che crea risonanza nella struttura dell’ozono. Poiché consideriamo sempre l’ibridazione dell’atomo centrale come l’ibridazione finale, l’ozono ha ibridazione sp2.
Geometria molecolare dell’O3
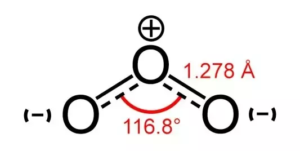
Come l’ibridazione della molecola determina la sua forma, possiamo ora conoscere la geometria molecolare dell’ozono. L’ozono ha ibridazione sp2 significa che dovrebbe avere una forma trigonale planare. Ma poiché la struttura dell’ozono ha risonanza e una coppia solitaria di elettroni, l’angolo tra le molecole è inferiore a 120 gradi.

Angoli di legame dell’O3
C’è sempre una forza repulsiva tra gli elettroni di legame che è inferiore alla repulsione tra una coppia solitaria ed elettroni di legame. In questo caso, poiché c’è solo una coppia di elettroni solitari, c’è una diminuzione dell’angolo da 120 a 116 gradi.

Forma dell’O3
Questa riduzione dell’angolo da 120 a 116 gradi causa una piegatura della forma, che risulta in una forma trigonale planare distorta. Molte volte la forma dell’ozono è anche considerata piegata o planare a causa della sua distorsione.
O3 polare o non polare
La polarità di ogni molecola dipende dalla sua geometria molecolare. Qui, la molecola di Ozono è piegata a causa dei suoi elettroni di valenza. Tutte e tre le molecole di ossigeno non sono lineari a causa della loro ibridazione sp2. Poiché le molecole non sono in geometria lineare, le loro interazioni di dipolo non sono annullate, e di conseguenza c’è un dipolo netto in questa molecola. Così c’è polarità nell’ozono, e si può dire che l’ozono è polare. Questa polarità è dovuta a una coppia solitaria di elettroni sull’atomo centrale dell’ozono.

Riservazioni conclusive
Per mettere tutto insieme, possiamo dire che:
L’ozono ha 18 elettroni di valenza di cui una coppia solitaria di elettroni.
Ha ibridazione sp2, geometria trigonale planare (piegata/angolare) ed è polare.