Tutti sappiamo molto bene cos’è il calore e cosa è capace di fare. Ma il calore specifico è un concetto che pochi conoscono. Inoltre, usiamo il calore specifico per aumentare di grado la temperatura di un oggetto. Inoltre, discuteremo il calore specifico, la formula del calore specifico, la sua derivazione ed esempi risolti in questo argomento. Inoltre, il calore specifico dei diversi elementi differisce l’uno dall’altro.
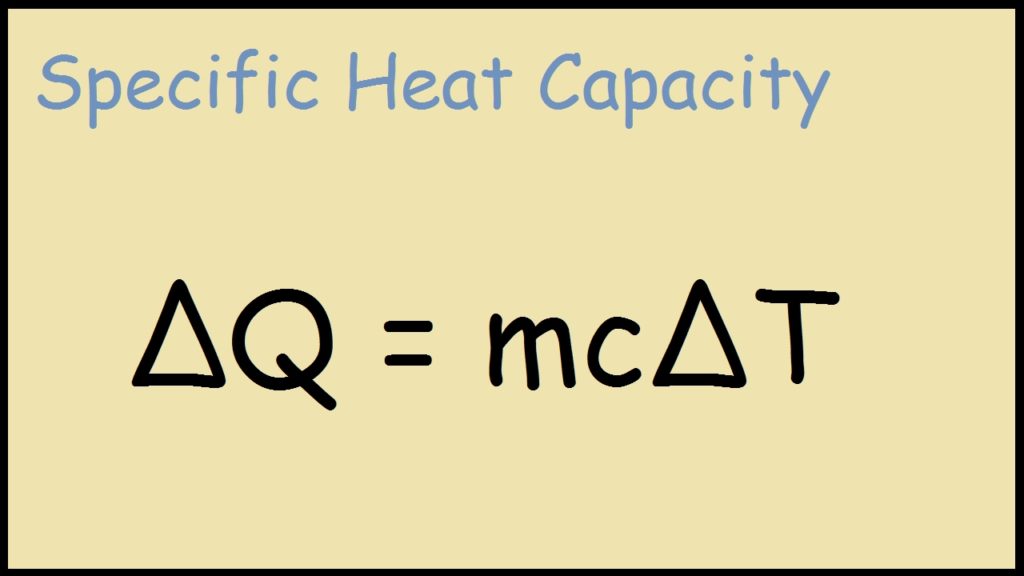
Fonte: YouTube
Calore specifico
Il calore specifico si riferisce al rapporto tra la quantità di calore di cui abbiamo bisogno per aumentare la temperatura di un corpo di un grado e quella necessaria per aumentare la temperatura di una massa equivalente di liquido (acqua) di un grado. Inoltre, usiamo il termine in un senso più stretto per indicare la quantità di calore, in calorie, di cui abbiamo bisogno per aumentare la temperatura di un grammo di una sostanza di un grado Celsius.
In parole semplici, è il rapporto tra la quantità di calore necessaria per aumentare la temperatura di un oggetto di un grado e la quantità di calore necessaria per aumentare la temperatura della stessa quantità di acqua di un grado.
Ottieni l’enorme lista di formule di fisica qui
Formula del calore specifico
Come abbiamo discusso sopra il calore specifico è il rapporto del cambiamento di temperatura di un oggetto con l’acqua.
Anche la formula è come questa:
Energia termica = (massa dell’oggetto o della sostanza) × (calore specifico) × (cambiamento di temperatura)
Q = m × c × \(\Delta T\)
Oppure
Q = \(mc\Delta T\)
Derivazione della formula del calore specifico
Esempi risolti sulla formula del calore specifico
Esempio 1
Se il calore specifico dell’oro è 129 \(J/kg\cdot k\). Allora quale quantità di energia termica è necessaria per aumentare la temperatura di 100 g di oro di 50,0 K?
Soluzione:
Calcolo:
Q = \(mc\Delta T\)
Q = (0,100 kg) (129 \(J/kg\cdot k\)) (50,0 K)
Quindi, l’energia richiesta per aumentare la temperatura di 100 g d’oro è 645 J.
Esempio 2
Supponiamo che una pentola sia riscaldata trasferendo 1676 KJ di energia termica all’acqua. Inoltre, se ci sono 5.000 kg di acqua nella pentola e la temperatura viene aumentata di 80.0 K, allora trova il calore specifico dell’acqua?
Soluzione:
Scriviamo le cose date nella domanda
Massa (m) = 5.00 kg
Temperatura (T) = 80.0 K
Calore specifico (c) = 1676 KJ
Ora dobbiamo convertire il calore specifico in Joule perché è in Kilojoule.
Quindi, la conversione è così
1 KJ = 1.000 J
Quindi, 1676 KJ = 1.000 × 1676 = 16.76.000 J
Ora mettere tutti i valori nella formula. Ma, prima di questo, dobbiamo riorganizzare la formula per trovare il calore specifico.
Q = \(mc\Delta T) \(\rightarrow\) c = \(\frac{Q}{m\Delta T})
Ora mettere i valori nella formula riorganizzata
C = \(\frac{1676000} {(5.00 kg)(80.0)}\)
C = 4190 \(J/kg\cdot k\)
Quindi, il calore specifico dell’acqua è 4190 \(J/kg\cdot k\).