US Pharm. 2020;45(6):30-32.
ABSTRACT: La FDA definisce un farmaco generico come un “farmaco creato per essere lo stesso di un farmaco di marca già commercializzato in forma di dosaggio, sicurezza, forza, via di somministrazione, qualità, caratteristiche di prestazione e uso previsto.” Il sistema sanitario statunitense ha risparmiato quasi 2 trilioni di dollari dal 2009 al 2019 in costi sanitari grazie all’uso dei generici, con un aumento dei risparmi ogni anno. Nonostante questa variazione dei costi, le barriere come la mancanza di comunicazione e di educazione, gli effetti collaterali precedenti o le preferenze possono giocare un ruolo nell’uso continuato dei farmaci di marca. L’aumento del mercato dei prodotti generici creerà concorrenza e, in ultima analisi, porterà ad un abbassamento dei prezzi dei farmaci e all’accesso a cure mediche abbordabili per un maggior numero di pazienti. È importante che i farmacisti educhino i pazienti e i fornitori sull’uso appropriato dei farmaci generici rispetto a quelli di marca.
La FDA definisce un farmaco generico come un “farmaco creato per essere lo stesso di un farmaco di marca già commercializzato in termini di forma di dosaggio, sicurezza, forza, via di somministrazione, qualità, caratteristiche di prestazione e uso previsto. “1,2 I farmaci generici, quindi, sono equivalenti ai prodotti di marca in termini di efficacia, qualità e sicurezza. Le Abbreviated New Drug Applications (ANDA) per l’approvazione dei generici devono dimostrare la bioequivalenza e che l’ingrediente attivo è lo stesso del nome di marca; possono differire in base agli ingredienti inattivi, ma queste differenze devono essere provate per non avere alcun effetto su come funziona il farmaco.1-3
Il Drug Price Competition and Patent Term Restoration Act del 1984, o Hatch-Waxman Act, ha permesso che i generici fossero approvati per l’uso sul mercato senza test preclinici e clinici per garantire che un generico fosse più economico rispetto al suo prodotto di marca equivalente. I generici hanno un costo inferiore dall’80% all’85% rispetto al loro prodotto di marca.1 Secondo i dati IQVIA 2019, il sistema sanitario statunitense ha risparmiato quasi 2 trilioni di dollari dal 2009 al 2019 grazie all’uso dei generici, con un aumento dei risparmi ogni anno.4,5 Secondo un rapporto dell’Association of Accessible Medicines (AAM), nel 2018 negli Stati Uniti sono state effettuate 4 miliardi di prescrizioni generiche, Tuttavia, questo rappresenta solo il 22% di tutta la spesa farmaceutica.5
A causa delle percezioni o delle esperienze passate con i farmaci generici, alcuni consumatori continuano a usare i farmaci di marca nonostante questa differenza di costo, il che può portare a un aumento della spesa dei consumatori, all’insoddisfazione del paziente e, infine, a una diminuzione dell’aderenza. Rispondere alle domande o discutere l’uso dei farmaci generici rispetto a quelli di marca o degli ingredienti inattivi rispetto a quelli attivi con i pazienti è un ruolo importante per i farmacisti per aiutare a migliorare la soddisfazione del paziente, l’aderenza e la qualità della vita. L’aumento del mercato dei prodotti generici creerà concorrenza e, in ultima analisi, porterà ad un abbassamento dei prezzi dei farmaci e all’accesso ad un’assistenza sanitaria economica per un maggior numero di pazienti.1
Punti di discussione
A causa di idee sbagliate e della mancanza di comprensione della differenza tra prodotti di marca e generici, educare i pazienti sui fatti è vitale. Delineati nei prossimi paragrafi sono concetti di discussione che possono essere importanti per i nostri pazienti.
Qual è la differenza tra ingredienti attivi e inattivi?
Un ingrediente attivo è il componente del farmaco che produce l’effetto farmacologico sul corpo. Gli ingredienti attivi possono subire cambiamenti chimici quando il prodotto viene fabbricato ed essere presenti in una forma modificata per fornire il suo effetto.6 Un esempio di questo sarebbe una formulazione a rilascio prolungato di un farmaco. Un ingrediente inattivo è un componente del farmaco che non influenza l’azione terapeutica del farmaco sul corpo. Gli ingredienti inattivi vengono aggiunti a un prodotto farmaceutico per aiutare a legare, insaporire, colorare, conservare o trasportare il farmaco. Alcuni esempi di ingredienti inattivi sono alcool, gelatina, galattosio, lattosio e saccarina.
Per ottenere l’approvazione della FDA, un farmaco generico deve contenere lo stesso ingrediente attivo del farmaco originale (cioè, il prodotto di marca). Anche se gli ingredienti inattivi possono essere diversi, la FDA conduce regolarmente esami approfonditi dei prodotti generici per garantire che soddisfino gli standard. La FDA capisce che ci può essere variabilità in ogni lotto prodotto, ma la quantità di variabilità è limitata. Questa variabilità può verificarsi tra i farmaci di marca e i generici, ma può avvenire anche tra le marche, a causa di lievi differenze nella produzione dei lotti.1 La FDA indaga anche sugli effetti collaterali riportati con un prodotto di marca o generico per determinare se sono necessari cambiamenti nella produzione.
Qual è la differenza tra un prodotto generico e un generico autorizzato?
Un prodotto generico è l’equivalente di un prodotto di marca fatto da una società separata dalla società che produce il prodotto di marca. Un generico autorizzato, tuttavia, può essere commercializzato dall’azienda farmaceutica di marca o dall’azienda con il permesso della marca, ma come generico ad un costo inferiore. I generici autorizzati sono uguali al farmaco di marca in quanto hanno gli stessi ingredienti attivi e inattivi, ma il loro aspetto può differire.7 Un generico autorizzato può non essere elencato nella lista dei farmaci generici della FDA, nota come Orange Book, poiché è commercializzato sotto la New Drug Application del marchio rispetto ai prodotti generici, che sono approvati dopo la presentazione di un ANDA.7,8
Sia i generici che i generici autorizzati possono avere un costo inferiore rispetto ai farmaci di marca poiché i produttori di generici non devono completare i test clinici che erano richiesti per i prodotti di marca.
C’è qualcosa a cui prestare attenzione quando si passa da un prodotto di marca a uno generico?
I farmaci di marca e quelli generici non possono avere lo stesso aspetto, a causa delle leggi sui marchi negli Stati Uniti. Le differenze di colore, forma, dimensione e sapore, tuttavia, non giocano un ruolo nel modo in cui i farmaci funzionano. Come detto in precedenza, la variabilità si verifica nei lotti, ma a livelli molto piccoli e non significativi. Per esempio, un grande studio che ha confrontato i generici con i farmaci di marca ha trovato piccole differenze di solo il 3,5% nell’assorbimento nel corpo tra i farmaci generici e quelli di marca.9
Possibili barriere alla prescrizione di generici e modi per superarle
Sondaggi e studi sono stati condotti negli anni per analizzare le barriere nell’uso dei generici o l’aumento del passaggio dai generici ai marchi. La TABELLA 1 fornisce una lista di possibili barriere alla prescrizione e alla distribuzione dei generici.10-15

Un sondaggio condotto su pazienti epilettici e le loro preoccupazioni sulle sostituzioni dei generici ha concluso che i pazienti credevano che i cambiamenti dovrebbero essere determinati solo dal fornitore o dal paziente. Queste preoccupazioni derivavano dalle preoccupazioni dei fornitori di crisi epilettiche in caso di cambio o di aumento del rischio di effetti collaterali e dalle preoccupazioni dei pazienti che i generici non possano fornire un’efficacia o una tollerabilità equivalente.16 Tuttavia, è stato anche dimostrato che avere un rapporto con il proprio farmacista e rendere il fornitore e i pazienti consapevoli dei cambiamenti del produttore può aiutare a migliorare l’uso dei generici nei pazienti epilettici.17
Inoltre, alcuni clinici e scienziati hanno espresso preoccupazioni sull’approvazione della bioequivalenza della FDA. Tuttavia, il Therapeutic Inequivalence Action Coordinating Committee, un gruppo di revisione post-marketing della FDA, identifica e valuta le segnalazioni di fallimenti terapeutici per determinare se è necessaria la rimozione dei prodotti non equivalenti.9 Inoltre, gli studi hanno concluso che i test di bioequivalenza richiesti dalla FDA sono solidi e aiutano a sostenere l’approvazione che i farmaci di marca e quelli generici sono terapeuticamente equivalenti.9
Gli studi hanno esaminato i tassi di switchback o la quantità di volte che i pazienti tornano ai farmaci di marca dai generici nonostante una differenza di costo. Gli studi che hanno esaminato i generici autorizzati e i generici hanno mostrato un tasso inferiore di switchback di marca grazie agli interventi per migliorare la comunicazione e l’educazione sull’equivalenza dei generici e dei prodotti di marca.11,12 Inoltre, le somiglianze nell’aspetto hanno anche impedito lo switchback di marca.11
A causa dei recenti richiami di prodotti generici, i pazienti possono anche essere apprensivi a passare ai generici in quanto potrebbero non essere prodotti negli Stati Uniti, credendo che i farmaci prodotti fuori dagli Stati Uniti non siano sicuri, nonostante l’approvazione della FDA. Una corretta educazione sui dettagli dei richiami è efficace per incoraggiare l’aderenza ai farmaci.14
Nonostante la disponibilità di un farmaco generico, l’uso di un prodotto di marca può essere clinicamente appropriato in situazioni selezionate. Per esempio, pazienti precedenti che assumono farmaci epilettici che hanno sperimentato un aumento della frequenza delle convulsioni con il passaggio a un generico possono essere appropriati per un passaggio a un farmaco di marca per il controllo delle convulsioni.15
Con le varie barriere discusse sopra, molteplici studi hanno dimostrato che promuovere interventi educativi per pazienti e fornitori può aiutare ad aumentare la fiducia nell’uso del generico.13 Inoltre, educare all’uso del generico può aiutare a migliorare la qualità della cura e l’aderenza ai farmaci. Il rapporto AAM del 2019 ha analizzato i tassi di abbandono dei farmaci, esaminando il tasso al quale i pazienti potrebbero non prendere o ritirare i loro farmaci nonostante la richiesta della prescrizione. Il rapporto conclude che i tassi di abbandono dei nuovi pazienti sono più alti del 266% per i farmaci di marca rispetto ai farmaci generici.5 I copagamenti hanno giocato un ruolo significativo in questo tasso di abbandono; il 90% dei copagamenti dei generici era inferiore a 20 dollari rispetto al 39% dei farmaci di marca.5
RISORSE DISPONIBILI PER ASSISTERE ALL’EDUCAZIONE
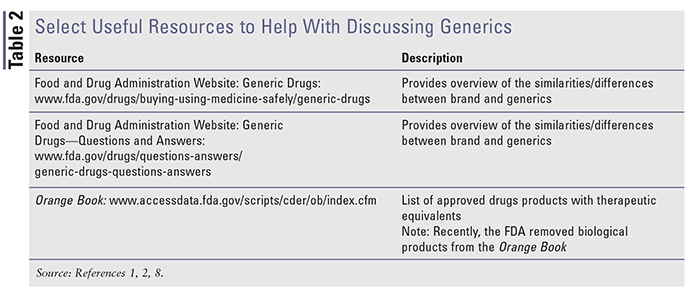
Sono disponibili molteplici risorse per aiutare a capire e discutere di marca e generici. Si prega di vedere la TABELLA 2 per una panoramica di alcune risorse utili disponibili.
CONCLUSIONE
Come farmacisti, abbiamo giurato di applicare le nostre conoscenze per assicurare risultati ottimali ai nostri pazienti e sostenere i cambiamenti che migliorano la cura del paziente. Migliorare l’aderenza, educare i nostri pazienti sui fatti e avere una comunicazione aperta con i fornitori di informazioni è vitale per noi per adempiere al nostro giuramento di farmacisti. La FDA completa un processo rigoroso per approvare i farmaci generici nel mercato statunitense; tuttavia, a causa delle percezioni o della quantità di informazioni attuabili, i pazienti possono essere apprensivi nell’assumere farmaci generici. Gli studi hanno dimostrato che superare le barriere ed educare i pazienti e i fornitori sui fatti del generico rispetto al marchio può aiutare a migliorare la prescrizione dei generici e, infine, a produrre un’assistenza sanitaria accessibile.
1. FDA. Farmaci generici. www.fda.gov/drugs/buying-using-medicine-safely/generic-drugs. Accessed March 19, 2020.
2. FDA. Farmaci generici: domande e risposte. www.fda.gov/drugs/questions-answers/generic-drugs-questions-answers. Accessed March 19, 2020.
3. Dunne S, Shannon B, Dunne C, Cullen W. A review of the differences and similarities between generic drugs and their originator counterparts, including economic benefits associated with usage of generic medicines, using Ireland as a case study. BMC Pharmacol Toxicol. 2013;14:1.
4. IQVIA Institute for Human Data Science. Spesa globale dei farmaci e tendenze di utilizzo: prospettive 2024. www.iqvia.com/-/media/iqvia/pdfs/institute-reports/global-medicine-spending-and-usage-trends.pdf?_=1586623006517. Accesso 20 marzo 2020.
5. Associazione per i farmaci accessibili. The case for competition: 2019 generic drug and biosimilars access and savings in the U.S. report. https://accessiblemeds.org/sites/default/files/2019-09/AAM-2019-Generic-Biosimilars-Access-and-Savings-US-Report-WEB.pdf. Accesso al 20 marzo 2020.
6. FDA. Approvazioni di farmaci e banche dati: ingrediente inattivo. www.fda.gov/drugs/drug-approvals-and-databases/inactive-ingredient-search-approved-drug-products-frequently-asked-questions. Accessed March 20, 2020.
7. FDA. Domanda Abbreviata di Nuovo Farmaco (ANDA): FDA elenco dei farmaci generici autorizzati. www.fda.gov/drugs/abbreviated-new-drug-application-anda/fda-list-authorized-generic-drugs. Accessed March 21, 2020.
8. FDA: Orange Book: prodotti farmaceutici approvati con valutazioni di equivalenza terapeutica. www.accessdata.fda.gov/scripts/cder/ob/index.cfm. Acceduto il 21 marzo 2020.
9. Davit BM, Nwakama PE, Buehler GJ, et al. Comparazione di farmaci generici e innovativi: una revisione di 12 anni di dati di bioequivalenza dalla United States Food and Drug Administration. Ann Pharmacother. 2009;43(10):1583-1597.
10. Choudhry NK, Denberg D, Qaseem A. Migliorare l’aderenza alla terapia e i risultati clinici contenendo i costi: opportunità da un maggiore uso di farmaci generici: consigli di buone pratiche dal Comitato di linee guida cliniche del Collegio americano dei medici. Ann Intern Med. 2016;164:41-49.
11. Desai RJ, Sarpatwari A, Dejene S, et al. Diff
12. Hansen RA, Qian J, Berg R, et al. Confronto dei tassi di switchback da generico a marca tra farmaci generici e generici autorizzati. Farmacoterapia. 2017;37(4):429-437.
13. Desai RJ, Sarpatwari A, Dejene S, et al. Efficacia comparativa dell’uso di farmaci generici e di marca: uno studio di database delle richieste di assicurazione sanitaria degli Stati Uniti. PLoS Med. 2019;16(3):e1002763.
14. FDA. Cosa sapere e fare su possibili nitrosammine nel tuo farmaco. www.fda.gov/consumers/consumer-updates/what-know-and-do-about-possible-nitrosamines-your-medication. Accessed May 13, 2020.
15. Straka RJ, Keohane DJ, Liu LZ. Potenziale impatto clinico ed economico del passaggio dei farmaci di marca ai generici. Am J Ther. 2017;24(3):e278-e289.
16. Ngo SNT, Stupans I, McKinnon RA. Sostituzione generica nel trattamento dell’epilessia: atteggiamenti e percezioni dei pazienti. Epilessia Behav. 2013;26:64-66.
17. Greb E. Studio rivela preoccupazioni circa il passaggio da farmaci antiepilettici di marca a generico. Neurology Rev. 2014;22(3):6.
Il contenuto di questo articolo è solo a scopo informativo. Il contenuto non è destinato a sostituire la consulenza professionale. L’affidamento su qualsiasi informazione fornita in questo articolo è esclusivamente a proprio rischio e pericolo.