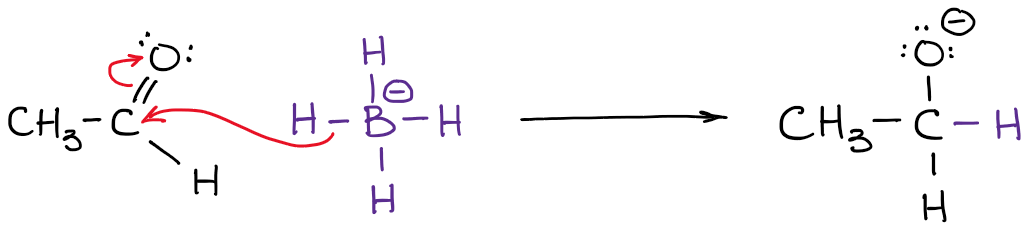Le cariche formali in chimica organica è, forse, uno dei dispositivi contabili più fondamentali che è spesso frainteso o trascurato dagli studenti.
Perché le cariche formali sono importanti in chimica organica?
Conoscere le cariche formali può aiutarci a capire i modelli di reattività nelle reazioni, trovare centri reattivi, e dare un senso al flusso degli elettroni nei meccanismi. Per esempio, le specie caricate negativamente tendono ad essere le fonti della densità di elettroni nelle reazioni, mentre le specie caricate positivamente accettano quegli elettroni.
Ecco un paio di esempi di molecole con cariche formali:
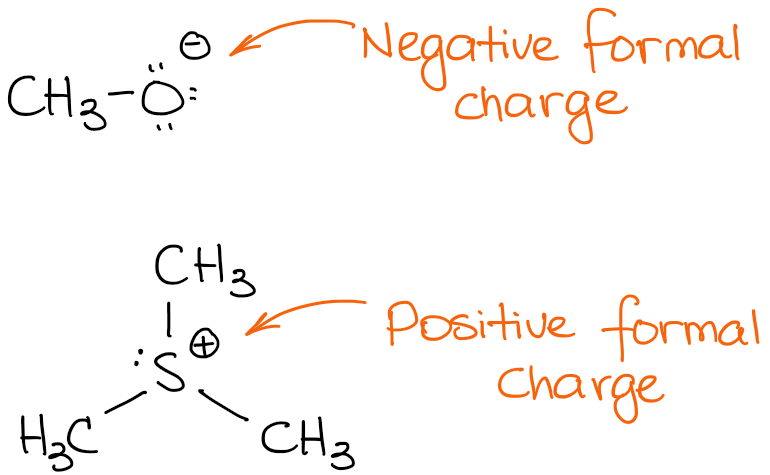
La specie superiore ha una carica negativa. Chiamiamo tali specie anioni. Poiché ha una carica negativa, significa che ha un eccesso di densità di elettroni. Quindi, è probabile che sia la fonte di questi elettroni in una reazione. Le fonti di densità di elettroni in una reazione organica agiscono come nucleofili o basi.
La seconda specie ha una carica positiva, quindi è una specie cationica. In una reazione, una specie cationica sarà un accettore di elettroni che agisce come un acido (sia Brønsted che Lewis) o come un elettrofilo.
È importante tenere a mente che una carica formale non è la stessa cosa di una carica reale! Ne parlerò un po’ più avanti in questo post.
Come calcolare una carica formale
Il modo “ufficiale” è sottrarre 1/2 elettroni di legame ed elettroni non di legame dai possibili elettroni di valenza che un atomo può avere. In altre parole:

Cosa sono tutti questi termini?
Gli elettroni di legame sono quelli che compongono i legami. Ogni legame contiene 2 elettroni. Quindi, 1/2 degli elettroni di legame è uguale al numero di legami che ha l’atomo.
Gli elettroni non leganti sono quelli che non partecipano a nessun legame. In altre parole, gli elettroni non leganti sono gli elettroni di riserva (di solito coppie di elettroni) su un atomo. Usando gli esempi di cui sopra abbiamo:

Le definizioni e il metodo “ufficiale” sembrano un po’ brutti. Come chimico professionista posso parlare tutto il giorno delle “regole ufficiali” e dei “nomi propri” e annoiarvi a morte. Invece, preferisco che usiate un semplice “trucco” che funziona sempre e, essenzialmente, è la stessa cosa. Il trucco è:
Carica formale = elettroni di valenza – bastoncini – punti
Il numero di elettroni di valenza è uguale al gruppo (colonna) dell’elemento nella tavola periodica. In questo modo, il carbonio ne ha 4, l’ossigeno ne ha 6 e l’idrogeno ha 1 elettrone di valenza. I legami e gli elettroni di riserva saranno indicati (o possono essere facilmente trovati da) la struttura di Lewis della molecola. Quindi, finché hai una struttura di Lewis completa e una tavola periodica a portata di mano, puoi trovare rapidamente la carica formale di qualsiasi atomo in una molecola.
La differenza tra la carica formale e quella effettiva
Ora, ho detto prima che c’è una differenza tra la carica formale e quella effettiva. La carica formale è uno strumento contabile che è importante per aiutarci a tenere traccia del flusso di elettroni nella reazione.
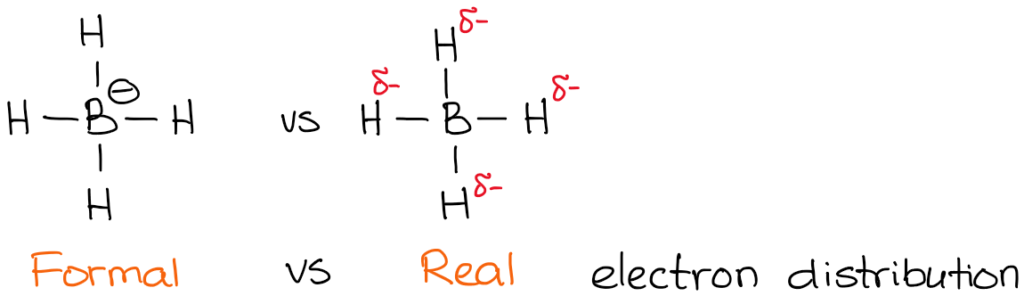
La carica effettiva, tuttavia, è la densità reale di elettroni che è presente sull’atomo. Per esempio, diamo un’occhiata all’anione boroidride:

L’elettronegatività del boro è 2.0 mentre l’elettronegatività dell’idrogeno è 2,2. Quindi, l’idrogeno è più elettronegativo (non di molto ma comunque) e polarizzerà il legame. Questo significa che l’idrogeno in realtà “tira” la densità di elettroni verso di sé. Quindi:
Mentre le cariche formali sono solo una “formalità”,”sono molto importanti per la comprensione dei meccanismi di reazione. Quindi devi assicurarti di padroneggiare l’abilità di trovare rapidamente la carica formale.
Hai anche notato che ho indicato le mie densità reali di elettroni con il simbolo delta-meno (𝛿-). Questo denota che ho solo una parziale carica negativa su ciascuno degli idrogeni. Quanto di questa carica parziale abbiamo su di loro? Beh, potremmo calcolarlo usando fantasiosi calcoli di chimica quantistica, ma questo è del tutto inutile ai fini di un tipico corso di chimica organica. Ciò che è più importante, è rendersi conto che il boro non è effettivamente carico negativamente in questa molecola. Quindi, quando scriviamo una reazione con un anione boroidride, non mostreremo elettroni provenienti dal boro!