Potresti aver sentito parlare del composto chimico che manca di legami C-H. Tali composti sono conosciuti come ‘composti inorganici’ in quanto non sono quelli organici a causa della mancanza di carbonio. Il trifluoruro di boro è il composto inorganico, e la sua formula è BF3. Non contiene alcun colore ed è un gas tossico. Crea fumi bianchi nell’aria umida. Se è sotto forma di liquido incolore, è molto solubile (diidrato.)
Contenuti
Geometria Molecolare di BF3
La geometria della molecola di BF3 è ‘Trigonale Planare’. Con il riferimento della chimica, ‘Trigonal Planar’ è un modello con tre atomi intorno a un atomo nel mezzo. È come se gli atomi periferici fossero tutti in un piano, poiché tutti e tre sono simili con gli angoli di legame di 120° su ciascuno che li rende un triangolo equilatero.
Struttura di Lewis di BF3

Per conoscere la struttura di Lewis di BF3, dobbiamo calcolare il numero totale di elettroni di valenza della molecola BF3. BF3 ha un totale di 24 elettroni di valenza, che dobbiamo impostare intorno all’atomo centrale. Prima di completare gli ottetti, non dimenticare di determinare quanti elettroni di valenza ci sono nel trifluoruro di boro e posizionarli di conseguenza.
Il boro sarà al centro della struttura perché è meno elettronegativo. Richiede sei elettroni di valenza nel suo guscio esterno. Se controlliamo le cariche formali per la struttura di Lewis del trifluoruro di boro, troveremo che sono zero anche se il boro ha solo sei elettroni di valenza.
Come disegnare la struttura di Lewis di BF3?
Per disegnare una struttura di Lewis, prima di tutto, aggiungi gli elettroni e disegna le connettività. Come discusso, qui ci sono 24 elettroni. Poi, aggiungi gli ottetti all’atomo esterno e gli elettroni extra all’atomo centrale. Ma, come sappiamo, non ci sono elettroni extra. (24 – 24 = 0)
Violazioni
Una cosa da tenere a mente mentre si disegna la struttura di Lewis è che la regola dell’ottetto può essere violata in queste tre situazioni; ma, non abbiamo bisogno di pensarci ogni volta perché è raro e queste eccezioni si verificano solo quando è necessario.
Eccezione 1: Se c’è un numero dispari di elettroni di valenza come 3,5,7, ecc.
Eccezione 2: Se ci sono pochissimi elettroni di valenza
Eccezione 3: Se ci sono troppi elettroni di valenza
Qui, in questo caso, l’elettrone centrale non ha nessun ottetto poiché ha sei particelle. Quindi, prova ad aggiungere più di un legame per decidere se l’atomo centrale può ottenere un ottetto o meno!
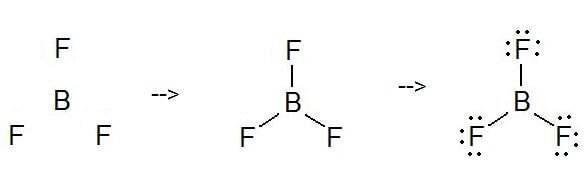
Come potete vedere, ora ha un ottetto.
Ibridazione BF3
L’ibridazione sta per mescolare orbitali atomici in nuovi orbitali ibridi. Sono accomodanti per spiegare la geometria molecolare e le proprietà di legame nucleare. Ci sono diversi tipi di ibridazione come SP3, SP2, SP. BF3 è un’ibridazione SP2. Per questa molecola, è SP2 perché un legame π (pi) è richiesto per il doppio legame tra il boro e solo tre legami σ sono formati per atomo di boro. Gli orbitali atomici S e P nel guscio esterno del boro si mescolano per formare tre orbitali ibridi SP2 equivalenti.
Polarità BF3
La polarità è una separazione di carica elettrica che porta una molecola o i suoi gruppi ad avere un momento di dipolo o multipolo elettrico. Se parliamo di contraddizione, allora la risposta è NO! BF3 non è polare. Quando la differenza di elettronegatività tra i due atomi è inferiore a 0,5, è maggioritariamente nonpolare.

Spero che questo articolo abbia senso per te e ti abbia aiutato a capire BF3 Lewis Structure, Molecular Geometry, Hybridization, and Polarity. Rimanete sintonizzati per sapere di più sulle diverse formule e altre cose importanti riguardanti la vostra amata chimica.