El elemento químico cesio se clasifica como un metal alcalino. Fue descubierto en 1860 por Robert Bunsen y Gustav Kirchhoff.

Zona de Datos
| El cesio es un metal alcalino | Color: | Amarillo/púrpura | Peso atómico: | 132.9055 |
| Estado: | sólido |
| Punto de fusión: | 28.4 oC , 301.6 K |
| Punto de ebullición: | 670 oC, 943.2 K |
| Electrones: | 55 | Protones: | 55 | Neutrones en el isótopo más abundante: | 78 | Capas de electrones: | 2,8,18,18,8,1 |
| Configuración de electrones: | 6s1 | Densidad a 20oC: | 1.873 g/cm3 |
Mostrar más, incluyendo: Calores, Energías, Oxidación, Reacciones,
Compuestos, Radios, Conductividades
| Volumen atómico: | 71.07 cm3/mol |
| Estructura: | bcc: cúbico centrado en el cuerpo |
| Dureza: | 0,2 mohs | Capacidad calorífica específica | 0,24 J g-1 K-1 |
| Calor de fusión | 2.092 kJ mol-1 |
| Calor de atomización | 76 kJ mol-1 |
| Calor de vaporización | 67.740 kJ mol-1 |
| 1ª energía de ionización | 375,7 kJ mol-1 |
| 2ª energía de ionización | 2234.3 kJ mol-1 |
| 3ª energía de ionización | 3400 kJ mol-1 |
| Afinidad de los electrones | 45.506 kJ mol-1 | Número de oxidación mínimo | 0 |
| Min. número de oxidación común | 0 |
| Número de oxidación máximo | 3 |
| Número de oxidación común máximo. | 3 |
| Electronegatividad (Escala de Pauling) | 0,79 |
| Volumen de polarizabilidad | 59.6 Å3 |
| Reacción con aire | vigorosa, ⇒ Cs2O |
| Reacción con 15 M HNO3 | vigorosa, ⇒ CsNO3 |
| Reacción con 6 M HCl | vigorosa, ⇒ H2, CsCl | Reacción con 6 M NaOH | vigorosa, ⇒ H2, CsOH | Óxido(s) | Cs2O, CsO2, Cs2O2 |
| Hidruro(s) | CsH |
| Cloruro(s) | CsCl |
| Radio atómico | 260 pm |
| Radio iónico (1+ ion) | 181 pm |
| Radio iónico (2+ ion) | – |
| Radio iónico (3+ ion) | Radio iónico (1- ion) | – |
| Radio iónico (2- ion) | Radio iónico (3- ion) | – |
| Conductividad térmica | 35.9 W m-1 K-1 |
| Conductividad eléctrica | 5,3 x 106 S m-1 |
| Punto de congelación/fusión: | 28,4 oC , 301.6 K |

Cristales de cesio de alta pureza bajo argón. Foto de Dennis S.K.
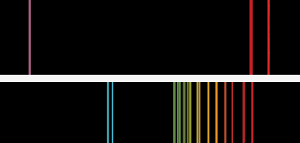
Espectro de emisión de llama básico similar al que vieron Bunsen y Kirchoff. El espectro superior es el del potasio, con la característica línea violeta. En el caso del cesio, las líneas gemelas de color azul cielo mostraban la presencia de un nuevo elemento.
Descubrimiento del cesio
El cesio fue el primer elemento descubierto mediante un espectroscopio.
Lo descubrieron Robert Bunsen y Gustav Kirchhoff en 1860 en Heidelberg, Alemania, cuando analizaron el espectro del agua mineral.
Un año antes, Bunsen y Kirchhoff habían desarrollado el espectroscopio. El aparato se basaba en un prisma que separaba la luz de una llama en un arco iris de colores.
En cada espectro que observaban, Bunsen y Kirchhoff encontraban líneas de color. Se dieron cuenta de que estas líneas eran exclusivas de la sustancia que se quemaba.
Al estudiar el espectro del residuo de agua mineral de un balneario, encontraron una serie de líneas de emisión de colores que no se correspondían con ningún elemento conocido.
Bunsen y Kirchhoff llamaron al elemento cesio, de la palabra latina ‘caesius’ que significa azul celeste, por las líneas azules que vieron en el espectro.
La ortografía latina aún se refleja en el inglés británico, donde cesio se escribe ‘caesium’.
En 1861 Bunsen y Kirchhoff también descubrieron el rubidio por el mismo método.


Reloj atómico de cesio. Con una precisión de 1 segundo en 300 millones de años.
Aspecto y características
Efectos nocivos:
El cesio debe mantenerse bajo un líquido/gas inerte o al vacío para protegerlo del aire y del agua. Los compuestos de cesio se consideran ligeramente tóxicos.
Características:
El cesio es un metal alcalino dorado plateado, blando y dúctil. Es líquido en una habitación cálida, fundiéndose a 28,4 oC (83,1 oF).
El cesio es uno de los pocos metales que es líquido cerca de la temperatura ambiente. Los otros son el galio, el francio y el mercurio.
El cesio es un metal extremadamente reactivo y el más alcalino de los elementos. Reacciona explosivamente al entrar en contacto con el agua produciendo hidróxido de cesio (CsOH), una base extremadamente fuerte que puede corroer rápidamente el vidrio.
Usos del cesio
El cesio se utiliza en los relojes atómicos, que son increíblemente precisos. El NIST-F2, el principal estándar de tiempo y frecuencia de Estados Unidos, es un reloj atómico de fuente de cesio desarrollado en los laboratorios del NIST en Boulder, Colorado. El NIST-F2 contribuye al grupo internacional de relojes atómicos que definen el Tiempo Universal Coordinado (UTC), la hora mundial oficial. A medida que los científicos siguen mejorando su tecnología, la incertidumbre en la medición del tiempo del NIST-F1 mejora continuamente. Actualmente no gana ni pierde ni un segundo en más de 300 millones de años. Véase también estroncio.
El cesio también se utiliza en las células fotoeléctricas y como catalizador en la hidrogenación de compuestos orgánicos. El metal se utiliza como «captador» en los tubos de vacío.
El hidróxido de cesio se utiliza para grabar el silicio.
Abundancia e isótopos
Abundancia corteza terrestre: 3 partes por millón en peso, 0.5 partes por millón en moles
Abundancia sistema solar: 8 partes por billón en peso, 70 partes por billón en moles
Coste, puro: 1100 dólares por 100g
Coste, a granel: dólares por 100g
Fuente: El cesio se encuentra en los minerales pollucita y lepidolita. Comercialmente, la mayor parte del cesio se produce como subproducto de la producción de litio metálico. Más de dos tercios de las reservas mundiales de cesio – 110.000 toneladas – se encuentran en el lago Bernic, Manitoba, Canadá.
Isótopos: El cesio tiene 36 isótopos cuya vida media se conoce, con los números de masa 112 a 148. El cesio que se produce de forma natural está formado por su único isótopo estable, el 133Cs.

Cite esta página
Para enlazar en línea, copie y pegue uno de los siguientes:
<a href="https://www.chemicool.com/elements/cesium.html">Cesium</a>
o
<a href="https://www.chemicool.com/elements/cesium.html">Cesium Element Facts</a>
Para citar esta página en un documento académico, por favor, utilice la siguiente cita conforme a MLA:
"Cesium." Chemicool Periodic Table. Chemicool.com. 10 Nov. 2014. Web. <https://www.chemicool.com/elements/cesium.html>.