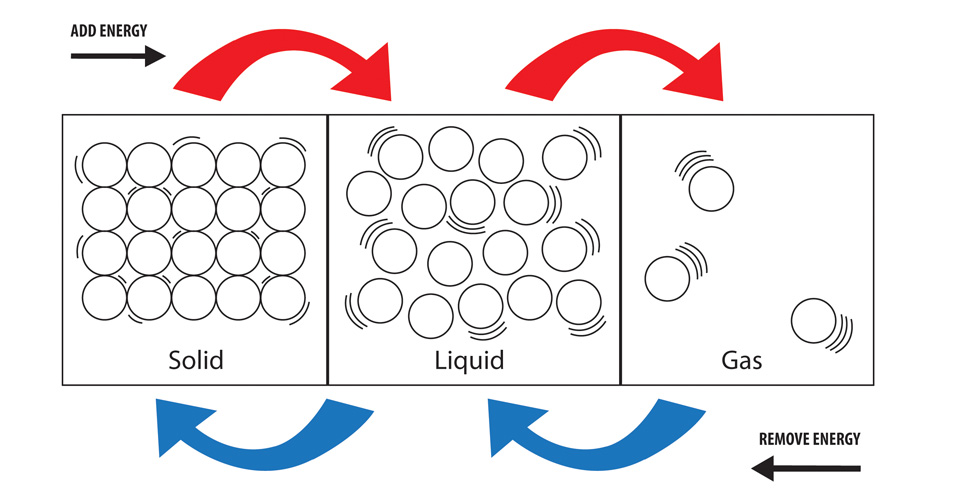
Dans un solide les particules ont la plus faible quantité d’énergie par rapport à celles de l’état liquide et de l’état gazeux (la plus grande quantité d’énergie des trois états). Les liaisons nécessitent de l’énergie pour se rompre et libèrent de l’énergie lorsqu’elles sont formées. Pour former un liquide à partir d’un solide, nous devons briser des liaisons et pour former un gaz à partir d’un liquide, nous devons briser encore plus de liaisons. Cela nécessite un apport d’énergie plus important chaque fois que davantage de liaisons sont rompues.
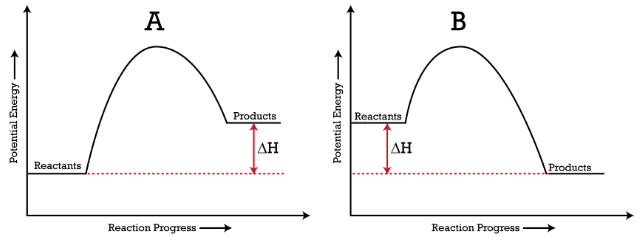
Les processus endothermiques ( graphique A ) sont ceux où l’énergie est absorbée par un système / des réactifs et où l’énergie des particules impliquées est plus élevée qu’avant que le processus ne se produise.
Les processus exothermiques ( graphique B ) sont l’inverse des processus endothermiques – l’énergie est libérée par un système / des réactifs et les particules impliquées ont une énergie plus faible après le processus qu’avant.
Liant cela aux états solide, liquide et gazeux, lorsque vous vaporisez une substance (la transformez en gaz), vous faites passer les particules de la substance dans un état où elles posséderont plus d’énergie. Cette énergie doit « venir » de quelque part et l’énergie est donc prélevée dans l’environnement du processus. Avec les changements d’état, cela se fait généralement sous forme de chaleur (bien que la pression puisse également être prise en compte).
La condensation est un gaz qui se transforme en liquide et donc un » état » de particules à haute énergie qui devient un » état » de particules à plus faible énergie. Si l’énergie globale des particules impliquées est plus faible qu’avant que le processus ne se produise, de l’énergie doit avoir été libérée et le processus peut donc être considéré comme exothermique.
.