Chaque orbitale est désignée par un nombre et une lettre.
Le nombre désigne le niveau d’énergie de l’électron dans l’orbitale. Ainsi, 1 désigne le niveau d’énergie le plus proche du noyau ; 2 désigne le niveau d’énergie suivant plus éloigné, et ainsi de suite.
La lettre désigne la forme de l’orbitale. Les lettres vont dans l’ordre s, p, d, f, g, h, i, j, etc. Les lettres s, p, d et f ont été attribuées pour des raisons historiques qui ne doivent pas nous concerner. Tout ce que nous avons à faire est de nous souvenir des formes qui correspondent à chaque lettre.
Puisqu’un électron peut théoriquement occuper tout l’espace, il est impossible de dessiner une orbitale. Tout ce que nous pouvons faire est de dessiner une forme qui inclura l’électron la plupart du temps, disons 95% du temps. Nous appelons cette forme le contour à 95 %.
s ORBITALES
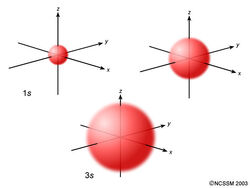
Une orbitale s est à symétrie sphérique autour du noyau de l’atome, comme une boule creuse faite d’un matériau plutôt pelucheux avec le noyau en son centre. À mesure que les niveaux d’énergie augmentent, les électrons sont situés plus loin du noyau, et les orbitales deviennent donc plus grandes. L’ordre de taille est le suivant : 1s < 2s < 3s < …, comme indiqué ci-dessous.
Maintenant, examinons une coupe transversale de ces orbitales.

Si vous regardez attentivement, vous remarquerez qu’une orbitale 1s a une densité électronique très faible près du noyau, mais qu’elle s’accumule jusqu’à un maximum à mesure que vous vous éloignez du noyau, puis diminue au-delà du contour. C’est un peu comme une balle de tennis creuse.
Une orbitale 2s est similaire à une orbitale 1s, mais elle possède une sphère de densité électronique à l’intérieur de la sphère extérieure, comme une balle de tennis à l’intérieur d’une autre. Il existe une surface entre les deux balles où la probabilité de trouver un électron est nulle. On appelle cette surface un nœud ou une surface nodale.
Une orbitale 3s est encore plus grande, et elle possède trois nœuds.
p ORBITALS
Tous les électrons n’habitent pas les orbitales s. Au premier niveau d’énergie, la seule orbitale disponible pour les électrons est l’orbitale 1s. Cependant, au deuxième niveau, il existe également des orbitales appelées orbitales 2p en plus de l’orbitale 2s.
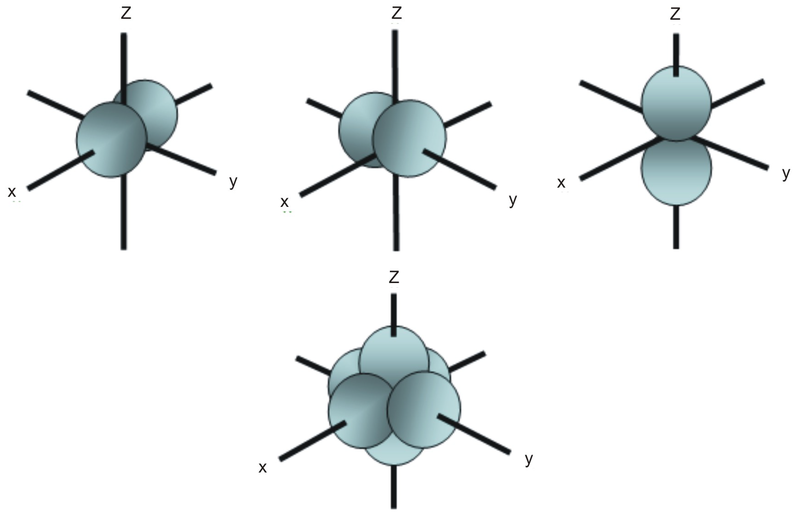
Contrairement à une orbitale s, une orbitale p pointe dans une direction particulière. Celle représentée ci-dessous pointe vers le haut et vers le bas de la page.

À n’importe quel niveau d’énergie, nous avons trois orbitales p absolument équivalentes pointant mutuellement à angle droit les unes par rapport aux autres. On leur attribue arbitrairement les symboles px, py et pz. C’est simplement par commodité, car ce que vous pourriez considérer comme la direction x, y ou z change constamment lorsque l’atome culbute dans l’espace.
Les orbitales p au deuxième niveau d’énergie sont appelées 2px, 2py et 2pz. Il existe des orbitales similaires aux niveaux suivants : 3px, 3py, 3pz, 4px, 4py, 4pz et ainsi de suite.
Tous les niveaux, sauf le premier, possèdent des orbitales p.
d ORBITALES
En plus des orbitales s et p, il existe deux autres ensembles d’orbitales qui deviennent disponibles pour les électrons à habiter à des niveaux d’énergie plus élevés. Au troisième niveau, il existe un ensemble de cinq orbitales d (aux formes et aux noms compliqués) ainsi que les orbitales 3s et 3p (3px, 3py, 3pz). Au troisième niveau, il y a un total de neuf orbitales en tout.
Les cinq orbitales 3d sont appelées
3dxy
3dxz
3dyz
3dx² – y²
3dz²

Pour donner un sens aux noms, nous devons les considérer en deux groupes. Le premier groupe contient les orbitales 3dxy, 3dxz et 3dyz. Les noms vous indiquent que ces orbitales se trouvent respectivement dans le plan x-y, le plan x-z et le plan y-z. Chaque orbitale a quatre lobes, et chacun des lobes pointe entre deux des axes, et non le long de ceux-ci.
Le deuxième groupe contient les orbitales 3dx² – y² et 3dz². Leurs lobes pointent le long des différents axes.
L’orbitale 3dx² – y² ressemble exactement au premier groupe, sauf que les lobes pointent le long des axes x et y, et non entre eux.
La 3dz² ressemble à une orbitale p portant un beignet autour de la taille.
Orbitales f
Au quatrième niveau et aux niveaux supérieurs, il existe sept orbitales f en plus des orbitales 4s, 4p et 4d.
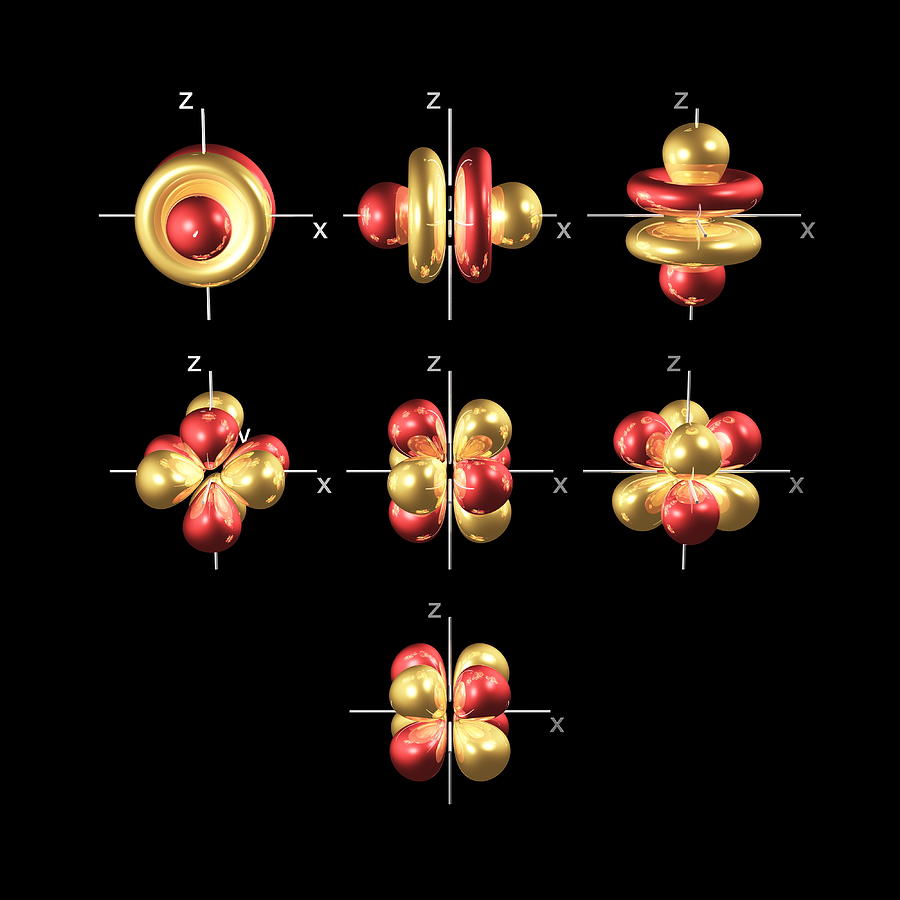
En comptant les orbitales 4s, 4p et 4d, cela fait un total de 16 orbitales au quatrième niveau. Elles ont des formes encore plus compliquées. Les orbitales s, p, d et f sont également disponibles à tous les niveaux d’énergie supérieurs. Heureusement, vous n’aurez probablement pas besoin de mémoriser les formes des orbitales f. Rappelez-vous simplement qu’il y a sept orbitales f dans chaque niveau à partir du niveau 4.