L’ozone est l’un des exemples les plus courants utilisés pour étudier la structure de Lewis. La molécule d’Ozone possède trois atomes d’oxygène. Elle est écrite sous la forme O3 dans les équations de base de la chimie. Pour comprendre l’hybridation, la polarité et la géométrie moléculaire de la molécule d’Ozone, il est crucial de connaître la structure de Lewis de cette dernière.
| Nom de la molécule | Ozone (O3). |
| 18 | |
| Hybridation de l’. O3 | hybridation sp2 |
| Angles de liaison | 116 degrés |
| . Géométrie moléculaire de O3 | Bent |
Maintenant, beaucoup de gens demandent pourquoi il est nécessaire de connaître la structure de Lewis d’une molécule ou d’un composé donné. La réponse à cette question est simple ; cette structure aide à comprendre la structure de base, les électrons qui participent à la formation des liaisons ainsi que les charges d’un atome donné.
La structure de Lewis est basée sur la règle de l’octuor. La règle de l’octet stipule qu’il doit y avoir huit électrons dans la coquille externe ou l’orbite de l’atome pour que la molécule soit stable. La structure de Lewis permet de connaître le nombre d’électrons de valence dans la molécule. Les électrons de valence sont les électrons qui participent à la formation des liaisons et des paires d’électrons non liants.
Les électrons qui participent à la formation des liaisons sont appelés paires d’électrons liants. Ces électrons sont représentés par des lignes de dessin dans la structure de Lewis. Tandis que les électrons qui ne participent pas à la formation de la liaison sont des paires d’électrons non liantes. Les points autour de l’atome central représentent ces électrons.
Contenu
Electrons de valence de l’O3
Dans l’ozone ou O3, il y a six électrons de valence pour chaque molécule d’oxygène.
Ici, comme il y a trois molécules d’oxygène, le nombre total d’électrons de valence est de 6*3= 18.
Donc il y a un total de 18 électrons de valence disponibles pour la molécule d’Ozone.
Structure de Lewis de O3
Comme la règle de l’octuor s’applique dans cette structure, l’atome central est le premier qui devrait avoir huit électrons dans sa coquille externe. Ainsi, une molécule de l’Oxygène se trouve au centre, les deux autres se trouvant sur les côtés opposés.
L’atome central possède une paire d’électrons solitaires et est stable grâce aux huit électrons de son orbite externe. Pour satisfaire à la règle de l’octuor, un atome central doit former une double liaison sur l’un de ses côtés avec une molécule d’oxygène et une autre liaison simple. Comme les deux molécules d’Oxygène ont la même électronégativité et la même structure, la double liaison continue à se déplacer des deux molécules.


Structures de résonance de O3
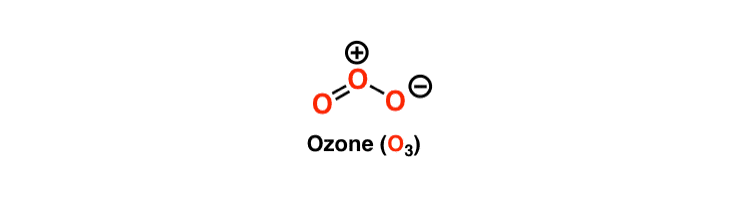
Cependant, la structure de l’Ozone est unique car l’atome central possède une double liaison et une liaison simple avec ses molécules d’oxygène voisines. Ces liaisons ne cessent d’interchanger leurs places, et donc l’ozone a une structure de Lewis résonante. La résonance signifie l’échange constant des liaisons entre les trois molécules d’ozone. L’atome central dans la structure de Lewis aura une charge de +1 et l’atome formant une seule liaison aura une charge de -1.


Hybridation de l’O3
L’hybridation en chimie signifie l’hybridation de deux ou plusieurs niveaux atomiques d’énergies identiques ou différentes pour se combiner et donner une nouvelle orbitale. Une fois que l’on connaît la structure de Lewis d’une molécule, il est facile de connaître l’hybridation de celle-ci. Comme l’ozone possède un atome central d’oxygène ayant huit électrons dans sa coquille la plus externe, l’hybridation de l’atome central sera sp2. Il y a deux électrons dans l’orbitale 2s, tandis que 6 électrons dans les deux orbitales 2p sur les trois orbitales 2p. Comme il y a des électrons dans une orbitale s, et deux orbitales p, l’hybridation de l’atome d’oxygène central devient sp2.
Les deux autres atomes d’oxygène ont également une hybridation. L’un aura une hybridation sp2, tandis que, l’autre aura une hybridation sp3 car il y a une paire d’électrons solitaires qui crée une résonance dans la structure de l’Ozone. Comme nous considérons toujours l’hybridation de l’atome central comme l’hybridation finale, l’Ozone a une hybridation sp2.
Géométrie moléculaire de l’O3
Comme l’hybridation de la molécule détermine sa forme, nous pouvons maintenant connaître la géométrie moléculaire de l’Ozone. L’Ozone a une hybridation sp2 signifie qu’il devrait avoir une forme plane trigonale. Mais comme la structure de l’Ozone a une résonance et une paire d’électrons solitaires, l’angle entre les molécules est inférieur à 120 degrés.

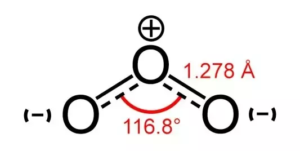
Angles de liaison de O3
Il existe toujours une force de répulsion entre les électrons de liaison qui est inférieure à la répulsion entre une paire solitaire et les électrons de liaison. Dans ce cas, comme il n’y a qu’une paire d’électrons solitaires, il y a une diminution de l’angle de 120 à 116 degrés.

Forme de l’O3
Cette réduction de l’angle de 120 à 116 degrés entraîne une courbure de la forme, qui se traduit par une forme plane trigonale déformée. Plusieurs fois, la forme de l’Ozone est également considérée comme courbée ou plane en raison de sa déformation.
O3 Polaire ou non polaire
La polarité de chaque molécule dépend de sa géométrie moléculaire. Ici, la molécule d’Ozone est courbée en raison de ses électrons de valence. Les trois molécules d’Oxygène ne sont pas linéaires en raison de leur hybridation sp2. Comme les molécules ne sont pas en géométrie linéaire, leurs interactions dipolaires ne sont pas annulées et, par conséquent, il y a un dipôle net dans cette molécule. Il y a donc une polarité dans l’ozone, et on peut dire que l’ozone est polaire. Cette polarité est due à une paire d’électrons solitaires sur l’atome central de l’Ozone.

Marques de conclusion
Pour tout mettre ensemble, nous pouvons dire que :
L’Ozone possède 18 électrons de valence parmi lesquels il y a une paire d’électrons solitaires.
Il a une hybridation sp2, une géométrie planaire trigonale ( bent/ angulaire) et il est polaire.
.