 Qu’est-ce qui est le mieux : un flacon de 100 $ de Xalatan de marque ou un flacon de 25 $ de latanoprost générique ? Cela semble être une question facile avec une réponse évidente, non ? Votre patient et son pharmacien peuvent certainement le penser, et n’ont aucun scrupule à choisir le générique beaucoup moins cher. Cependant, devez-vous être aussi attentif aux coûts ? Après tout, si le générique ne fonctionne pas correctement, alors même les 25 dollars sont un gaspillage – et la vision du patient peut être en danger.
Qu’est-ce qui est le mieux : un flacon de 100 $ de Xalatan de marque ou un flacon de 25 $ de latanoprost générique ? Cela semble être une question facile avec une réponse évidente, non ? Votre patient et son pharmacien peuvent certainement le penser, et n’ont aucun scrupule à choisir le générique beaucoup moins cher. Cependant, devez-vous être aussi attentif aux coûts ? Après tout, si le générique ne fonctionne pas correctement, alors même les 25 dollars sont un gaspillage – et la vision du patient peut être en danger.
Parfois, vous en avez effectivement pour votre argent.
D’un autre côté, les médicaments génériques fonctionnent suffisamment bien la plupart du temps et ils offrent des économies très réelles – non seulement pour les patients individuels, mais aussi pour le système de santé dans son ensemble.
Quand est-il préférable de prescrire le médicament générique ou le médicament d’origine ? C’est une question déroutante. Mais avec un peu plus d’informations – que nous aborderons dans cet article – vous aurez sans doute une meilleure maîtrise de la façon d’y répondre pour chaque patient.
Sur la base de la bioéquivalence
Alors que le fabricant initial du médicament de marque doit se soumettre à des tests rigoureux et à de longs essais cliniques lorsqu’il présente sa demande à la Food and Drug Administration (FDA), les entreprises qui produisent des médicaments génériques se contentent de se soumettre à une forme abrégée du processus d’approbation. La sécurité et l’efficacité n’ont pas à être prouvées ou établies avec les génériques, car des tests approfondis sur le médicament de marque ont vraisemblablement déjà été effectués. Les entreprises doivent simplement montrer à la FDA que leurs médicaments sont bioéquivalents à ceux de la marque.1 Actuellement, pour prouver la bioéquivalence, les scientifiques doivent prouver que le générique se situe dans une fourchette acceptable de la concentration indiquée sur l’étiquette. Typiquement, ceci est accompli en s’assurant que la version générique libère son ingrédient actif dans la circulation sanguine à la même vitesse et dans la même quantité que le médicament de marque.1
Alors que ceci est relativement facile à mesurer avec les médicaments systémiques, la bioéquivalence des médicaments ophtalmiques ne peut pas être testée de manière fiable de la même manière. De plus, les concentrations sanguines d’un médicament ophtalmique appliqué directement sur l’œil ne sont probablement pas importantes pour évaluer son efficacité. Ainsi, les seules stipulations de la FDA pour les médicaments génériques ophtalmiques sont qu’ils contiennent la même concentration de l’ingrédient actif, le même dosage et la même voie d’administration.2
Sans véritable test de bioéquivalence pour les médicaments ophtalmiques, les praticiens des soins oculaires doivent supposer qu’ils fonctionnent aussi bien les uns que les autres ; cependant, nous savons tous que ce n’est pas toujours le cas. La plupart des fournisseurs de soins oculaires se souviennent probablement de la série de patients qui, au début des années 2000, ont subi des fusions de la cornée associées à l’utilisation de la solution ophtalmique générique de diclofénac (par opposition à la marque Voltaren) après une chirurgie oculaire. Dans un article, trois patients sur cinq ayant subi une fonte de la cornée prenaient du diclofénac générique, et quatre patients ont finalement évolué vers une perforation de la cornée qui a nécessité une transplantation.3
Problèmes potentiels avec les génériques
Les médecins et les analystes des politiques de santé s’accordent largement à dire que les médicaments génériques peuvent apporter des économies importantes aux coûts des soins de santé. Une étude réalisée en 2002 par l’Institut Schneider pour la politique de santé de l’Université Brandeis a indiqué que si l’utilisation des génériques était accrue par les bénéficiaires de Medicare, des économies théoriques de plusieurs milliards de dollars de soins de santé pourraient être réalisées.4 Un rapport de 2005 a estimé que pour chaque augmentation de 1 % de l’utilisation des médicaments génériques, les dépenses globales en médicaments sur ordonnance seraient réduites de 1,3 à 4 milliards de dollars par an.5
En revanche, il est possible que les visites de suivi des médecins augmentent en nombre et/ou en fréquence si la compagnie d’assurance ou le patient prend la décision de passer aux médicaments génériques. Cela pourrait effectivement annuler les économies réalisées sur les soins de santé.
En particulier pour les médicaments contre le glaucome, certains praticiens pourraient être plus enclins à faire revenir les patients plus tôt pour vérifier l’efficacité et la tolérance du médicament générique qu’ils ne le feraient normalement si aucun changement n’avait eu lieu. En raison du nombre croissant de fabricants de génériques et de la possibilité de différences d’efficacité entre les génériques, un spécialiste du glaucome est allé jusqu’à recommander de suivre chaque type de générique en demandant à ses patients d’apporter les flacons à chaque visite. En procédant ainsi, il peut suivre chaque type de générique et surveiller les tendances en matière d’efficacité et de tolérance.6
Alors que la FDA établit des directives définitives pour les médicaments génériques produits aux États-Unis, les usines de fabrication à l’étranger peuvent ne pas être suivies d’aussi près. Bien que la demande d’une entreprise à la FDA doive inclure une description complète des installations qu’elle utilise pour la fabrication, les tests et l’emballage, il peut y avoir des restrictions budgétaires qui empêchent chaque installation à l’étranger d’être inspectée selon le même calendrier que celles aux États-Unis.7
On s’inquiète également des ingrédients des médicaments génériques provenant de sources possibles moins surveillées, comme l’Inde et la Chine. Par exemple, une étude de 2005 a révélé que 20 % des collyres génériques à la ciprofloxacine achetés en Inde étaient sous-potents, et que certaines préparations de la teneur en antibiotique étaient suffisamment faibles pour affecter négativement les résultats du traitement.8
Avec les médicaments génériques, une augmentation des symptômes d’allergie d’un mois à l’autre peut se produire s’il existe une différence entre les fabricants dans les conservateurs et/ou les ingrédients inactifs qu’ils utilisent. Si la pharmacie reçoit le médicament de différentes entreprises d’un mois à l’autre, cela pourrait potentiellement entraîner une plus grande toxicité de la surface oculaire, une mauvaise tolérance et le retour des patients pour une visite » yeux rouges « .
Il suffit de remonter aussi loin que les problèmes liés au Travatan (travoprost, Alcon) conservé avec du chlorure de benzalkonium (BAK) pour voir la possibilité de problèmes avec certains conservateurs.9 Comme indiqué précédemment, les médicaments génériques ne doivent avoir que la même concentration de l’ingrédient actif, ce qui signifie que les ingrédients inactifs et les conservateurs sont souvent différents. Par conséquent, un nombre accru de visites au cabinet pour vérifier l’efficacité et la tolérance d’un médicament générique pourrait théoriquement entraîner une augmentation des coûts des soins ophtalmologiques et annuler les économies réalisées grâce au prix inférieur du médicament.6
Le nombre croissant de fabricants de médicaments génériques peut entraîner une apparence incohérente des flacons et une incertitude accrue des patients quant à la bonne observance. Les producteurs de médicaments génériques doivent suivre des normes de fabrication et se conformer aux réglementations en matière d’étiquetage, qui interdisent aux flacons de médicaments génériques de ressembler à leurs homologues de marque.10 Cela peut finalement entraîner une confusion chez les patients s’il y a une couleur de bouchon différente, une couleur d’étiquette différente ou une taille de flacon variable d’un mois à l’autre. Une étude a révélé que 36 % des personnes ont déclaré qu’elles seraient contrariées ou inquiètes si la couleur ou l’apparence du flacon de leur médicament changeait sous quelque forme que ce soit11
Certains médicaments génériques se sont également avérés avoir des tailles de compte-gouttes différentes, ce qui peut faire varier la taille des gouttes, le nombre de doses dans le récipient et, en fin de compte, le coût d’un approvisionnement mensuel12. De plus, des inquiétudes ont été exprimées concernant les plastiques utilisés dans les flacons de médicaments et le contrôle de la qualité et ce que cela signifie en termes d’efficacité.6
Nous devons reconnaître l’importance de notre rôle dans l’éducation des patients concernant ces différences potentielles et nous assurer que nos patients nous contactent s’ils ont des questions sur leur traitement.
Etudes sur les génériques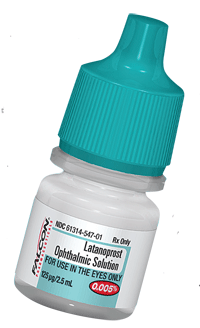 – Gouttes pour le glaucome. Actuellement, le médicament ophtalmique générique qui fait le plus parler de lui est le latanoprost 0,005%, la version commerciale du Xalatan (Pfizer). Actuellement, « The Orange Book », le texte de la FDA contenant « les produits pharmaceutiques approuvés avec équivalence thérapeutique », énumère sept fabricants approuvés de latanoprost générique.13
– Gouttes pour le glaucome. Actuellement, le médicament ophtalmique générique qui fait le plus parler de lui est le latanoprost 0,005%, la version commerciale du Xalatan (Pfizer). Actuellement, « The Orange Book », le texte de la FDA contenant « les produits pharmaceutiques approuvés avec équivalence thérapeutique », énumère sept fabricants approuvés de latanoprost générique.13
L’efficacité des médicaments génériques pour le glaucome présente un intérêt particulier pour la communauté ophtalmique. Bien que le générique puisse être moins cher et permettre des économies importantes, on craint que les médicaments génériques contre le glaucome n’aient pas le même effet que leur version commerciale, ce qui pourrait entraîner une progression de la maladie et une perte de vision14.
Toutefois, une étude récente qui a comparé le latanoprost générique au Xalatan a révélé que les deux traitements ont démontré une sécurité et une tolérance comparables chez les patients.15 Prenez note, cependant, que 99,6 % des patients de l’étude étaient blancs, donc ces résultats peuvent ne pas être les mêmes chez les Afro-américains, les Asiatiques et les Hispaniques. De plus, on pourrait arguer qu’il y a peut-être eu un biais de l’investigateur parce que Bausch + Lomb, le producteur du générique, a mené l’étude.
Auparavant, il n’y avait eu qu’une seule autre étude menée sur une formulation générique de latanoprost en 2007.16 L’étude comprenait 30 patients qui ont été randomisés en deux groupes ; ils ont reçu soit Xalatan, soit un latanoprost générique (Latoprost , produit en Inde) pendant les 12 premières semaines, puis sont passés à l’autre médicament pour les 12 dernières semaines. Les chercheurs ont constaté que les patients qui sont passés du Latoprost au Xalatan ont connu une baisse supplémentaire de la PIO. En revanche, lorsque les sujets sont passés du Xalatan au Latoprost, la PIO a augmenté de plus de 1 mm Hg en moyenne. Dans l’ensemble, le générique, qui est formulé à un pH plus élevé que le produit de marque, s’est avéré moins efficace pour abaisser la PIO.16
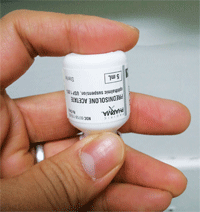
Au moins une étude a constaté que l’acétate de prednisolone générique a des particules beaucoup plus grosses, qui se déposent de la suspension à un rythme plus rapide, coulent au fond et nécessitent une plus grande agitation par le patient.
Des inquiétudes ont également été soulevées concernant la prescription de la version générique de la solution gélifiée de timolol. Des chercheurs ont montré que le temps de rétention sur la surface oculaire diffère entre les différents véhicules de gel à libération prolongée. Plus précisément, la gomme gellane présente dans Timoptic-XE (solution ophtalmique gélifiée de maléate de timolol, Merck) peut permettre au médicament d’origine d’avoir un contact de surface plus long, une meilleure absorption et une activité bêta-bloquante intraoculaire17. Dans une étude de 2002, il a été démontré que la version de marque de la solution gélifiée de timolol à base de gomme de gellane abaissait mieux la PIO que son homologue générique à base de gomme de xanthane.18 Par conséquent, certaines personnes dans le domaine médical ont proposé que des considérations, telles que la taille des particules et d’autres propriétés d’une suspension, doivent être évaluées pour l’équivalence générique.19
– Gouttes de stéroïdes. Plusieurs études et cas de ces dernières années ont également illustré la nécessité de faire preuve de prudence et de vigilance lors du traitement de l’inflammation avec des stéroïdes ophtalmiques. Allergan a noté dans ses mémorandums aux médecins que la suspension microfine de son Pred Forte (acétate de prednisolone) est plus uniforme, reste plus longtemps dans le sac conjonctival et minimise l’irritation mécanique de l’œil par rapport à l’acétate de prednisolone générique20.
Une étude réalisée en 2007 a examiné les différences de taille des particules entre Pred Forte, EconoPred Plus et l’acétate de prednisolone générique à 1 %21.L’hypothèse était que les particules plus grosses se déposaient hors de la suspension à un rythme plus rapide, coulaient au fond et nécessitaient une plus grande agitation par le patient. Les résultats de l’étude ont révélé que la forme générique de l’acétate de prednisolone avait une plus grande tendance à l’agglomération des particules, ce qui entraînait par la suite une concentration inégale de la dose.21 En outre, les auteurs ont écrit que les particules de plus grande taille pouvaient potentiellement obstruer l’embout du flacon de médicament lors de l’instillation et altérer davantage la cohérence et la concentration de la dose. En revanche, la taille des particules dans Pred Forte était plus petite et plus uniforme, ce qui leur permettait de rester en suspension plus longtemps et donnait un dosage plus précis de la goutte.21
Les optométristes doivent considérer que les produits dont les ingrédients sont mal suspendus peuvent potentiellement compromettre le traitement des yeux fortement enflammés.
Perspective du patient
– Coût et observance. Théoriquement, les médicaments génériques devraient améliorer la prise en charge et l’observance des patients car l’obstacle du coût a été supprimé. Avec un analogue de prostaglandine plus abordable désormais disponible, les patients précédemment sous timolol générique, dorzolamide générique ou ceux qui avaient refusé le traitement peuvent choisir de prendre du latanoprost générique. Ce type de passage d’une classe de médiations du glaucome à l’autre devrait également conduire à une observance nettement plus importante en raison de la posologie uniquotidienne de la prostaglandine.
– Complexe d’infériorité. Un autre problème potentiel est que les patients peuvent être réticents à passer à un médicament générique parce qu’ils les perçoivent comme inférieurs à leur homologue de marque.22 Les génériques sont souvent considérés comme des médicaments de second ordre en raison de la perception d’une faible conformité aux pratiques de fabrication standard, du manque de connaissances des patients sur les génériques et de l’influence du fabricant de marque.22,23 Selon une étude menée en Nouvelle-Zélande, moins de la moitié des participants interrogés ont perçu les médicaments génériques comme étant sûrs, efficaces et de qualité égale par rapport à leur homologue de marque.11
En outre, l’étude néo-zélandaise a révélé que les patients plus jeunes qui avaient une meilleure connaissance et une meilleure compréhension des différences entre les médicaments étaient plus susceptibles que ceux qui avaient une mauvaise compréhension des médicaments de dire qu’ils utiliseraient un médicament générique dans les maladies majeures et mineures.11 Nous devons éduquer nos patients afin qu’ils puissent prendre une décision éclairée sur leur traitement et être prêts à essayer un médicament générique si la situation s’y prête. Cela est particulièrement vrai chez les personnes âgées qui peuvent prendre plusieurs médicaments, ainsi que chez les personnes de faible statut socio-économique qui pourraient bénéficier des économies réalisées.
– Les préférences du patient. Nous devons souvent tenir compte de la personnalité et de l’expérience passée de notre patient lorsque nous décidons entre les médicaments génériques et les médicaments de marque également. Une question importante à poser à nos patients est de savoir s’ils ont déjà pris des génériques et quel a été le résultat. Si le patient a eu une mauvaise expérience, il peut avoir un parti pris pour les médicaments de marque et être prêt à payer le prix plus élevé.
La gravité de la maladie peut également influencer la volonté d’un patient de prendre un médicament générique. Selon la même étude menée en Nouvelle-Zélande, les personnes interrogées étaient plus disposées à passer à un générique pour une maladie mineure que pour une maladie grave (79 % contre 58,7 %).11 Dans le cas d’une maladie grave comme le glaucome, qui peut entraîner une perte de vision permanente, les patients peuvent être moins disposés à passer à un générique.
Quelle histoire croire ?
La véritable sécurité et l’efficacité des médicaments génériques ne peuvent être certaines sans essais cliniques tête-à-tête comparant les médicaments ophtalmiques topiques de marque à leurs homologues génériques, mais actuellement les données sont limitées19. Pour l’instant, voici ce que nous faisons :
Un patient atteint d’un glaucome avancé ou en phase terminale, qui présente un risque élevé de progression et de perte de vision, devrait probablement s’en tenir au médicament de marque pour maintenir la PIO sous bon contrôle.
Chez les patients souffrant d’une inflammation oculaire secondaire à un iritis, compte tenu des recherches susmentionnées, nous préférons prescrire Pred Forte plutôt qu’un générique lorsque cela est possible.
De même, en raison du manque d’informations concernant l’efficacité des médicaments génériques pour le glaucome, chez les patients atteints de glaucome avancé ou en phase terminale qui présentent un risque élevé de progression et de perte de vision, nous envisageons fortement de rester avec le médicament de marque qui permet de bien contrôler les PIO du patient. Nous ne voulons pas risquer de perdre le contrôle de la maladie ou de provoquer une toxicité oculaire en passant d’un médicament de marque à un médicament générique.
Préparer une lettre de stock pour la compagnie d’assurance, qui indique que votre patient souffre d’un » glaucome avancé ou au stade final menaçant la vision » et qu’il a été stable avec ses médicaments actuels, sera utile si et quand cette situation se présente. Une autre option consiste à faire passer les patients à un médicament de marque pour lequel il n’y a pas de générique disponible à ce moment-là (c’est-à-dire faire passer le patient du Xalatan à une prostaglandine de marque différente), tant qu’une efficacité similaire est obtenue.
Dans l’ensemble, nous devons éduquer nos patients sur le potentiel d’allergie et de faible efficacité des médicaments génériques. De plus, davantage de visites au cabinet peuvent être nécessaires pour évaluer l’effet de réduction de la PIO entre les médicaments génériques et les médicaments de marque pour le glaucome, ainsi que d’autres médicaments ophtalmiques.
En outre, nous devons dire aux patients de nous contacter s’ils ressentent des effets indésirables après être passés à un médicament générique. Tant que l’efficacité est comparable et qu’il n’y a pas de réactions allergiques, les génériques constituent une option de traitement alternative abordable qui devrait être utilisée et prescrite à nos patients.
En tant que fournisseurs de soins ophtalmologiques, nous devons nous rappeler que lors du choix entre les médicaments génériques et les médicaments de marque, il y a deux côtés de l’histoire.
Le Dr Chu et le Dr Hamp voient de grandes populations de patients atteints de maladies avancées. Ils donnent chacun des conférences sur le glaucome et d’autres sujets cliniques. Ils n’ont aucun intérêt financier ou propriétaire dans les médicaments et/ou les entreprises susmentionnés.
1. Cantor LB. Processus d’approbation des médicaments génériques ophtalmiques : implications pour l’efficacité et la sécurité. J Glaucoma. 1997 Oct;6(5):344-9.
2. Fiscella RG. Peser le choix entre les médicaments génériques et les médicaments de marque. Encart dans Cat Refr Surg Today. Juin 2010. Disponible à l’adresse suivante : http://bmctoday.net/crstoday/2010/06/insert/article.asp?f=weighing-the-choice-between-generic-and-branded-drugs (consulté en janvier 2012).
3. Lin JC, Rapuano CJ, Laibson PR, et al. Corneal melting associated with use of topical nonsteroidal anti-inflammatory drugs after ocular surgery. Arch Ophthalmol. 2000 Aug;118(8):1129-32.
4. Administration américaine des aliments et des médicaments. Un meilleur accès aux médicaments génériques : Nouvelles initiatives de la FDA pour améliorer le processus d’examen des médicaments et réduire les failles juridiques. Janvier 2006. Disponible sur : www.fda.gov/drugs/resourcesforyou/consumers/ucm143545.htm (consulté en janvier 2012).
5. Audience du sous-comité de la santé du comité de l’énergie et du commerce, Chambre des représentants, 109e Congrès. Augmenter l’utilisation des médicaments génériques : Saving Money for Patients. 18 mai 2005. Disponible sur : www.gpo.gov/fdsys/pkg/CHRG-109hhrg21639/pdf/CHRG-109hhrg21639.pdf (consulté en janvier 2012). oewen NA, Realini T, Ruderman JM, Smit B. Xalatan goes generic : a landmark event in glaucoma. Glaucome aujourd’hui. Early Summer 2011:55-8.
7. U.S. Food and Drug Administration. La FDA assure l’équivalence des médicaments génériques. Disponible sur : www.fda.gov/Drugs/EmergencyPreparedness/BioterrorismandDrugPreparedness/ucm134444.htm (consulté en janvier 2012).
8. Weir RE, Zaidi FH, Charteris DG, et al. Variabilité du contenu des collyres génériques indiens à la ciprofloxacine. Br J Ophthalmol. 2005 Sep;89(9):1094-6.
9. Baudouin C, Riancho L, Warnet JM, et al. Études in vitro d’analogues de prostaglandines antiglaucomateux : travoprost avec et sans chlorure de benzalkonium et latanoprost conservé. Invest Ophthalmol Vis Sci. 2007 Sep;48(9):4123-8.
10. Gallardo MJ, Fiscella RG, Whitson JT. Médicaments génériques pour le glaucome. Glaucome aujourd’hui. 2006 Jan-Feb;4(1):32-5.
11. Babar ZU, Stewart J, Reddy S, et al. An evaluation of consumers’ knowledge, perceptions and attitudes regarding generic medicines in Auckland. Pharm World Sci. 2010 Aug;32(4):440-8.
12. Kirkner RM. Mythes et réalités du latanoprost générique. Bureau de l’ophtalmologie. Juin 2011.
13. U.S. Food and Drug Administration. Orange Book : Produits pharmaceutiques approuvés avec des évaluations d’équivalence thérapeutique. Dernière mise à jour : 28 octobre 2011. Disponible sur : www.accessdata.fda.gov/scripts/cder/ob/default.cfm (consulté en janvier 2012).
14. Bell NP, Ramos JL, Feldman RM. Sécurité, tolérance et efficacité d’une thérapie d’association fixe avec le dorzolamide hydrocholoride 2% et le maléate de timolol 0,5% dans le glaucome et l’hypertension oculaire. Clin Ophthalmol. 2010 Nov 22;4:1331-46.
15. Allaire C, Dietrich A, Allmeier H, et al. La formulation test du latanoprost 0,005% est aussi efficace que le Xalatan chez les patients souffrant d’hypertension oculaire et de glaucome primaire à angle ouvert. Eur J Ophthalmol. 2012 Jan;22(1):19-27.
16. Narayanaswamy A, Neog A, Baskaran M, et al. Une étude pilote randomisée, croisée et ouverte pour évaluer l’efficacité et la sécurité de Xalatan en comparaison avec le latanoprost générique (Latoprost) chez les sujets atteints de glaucome primaire à angle ouvert ou d’hypertension oculaire. Indian J Ophthalmol. 2007 Mar-Apr;55(2):127-31.
17. Meseguer G, Buri P, Plazonnet B, et al. Comparaison par scintigraphie gamma de gouttes oculaires contenant de la pilocarpine chez des volontaires sains. J Ocul Pharmacol Ther. 1996 Winter;12(4):481-8.
18. Stewart WC, Sharpe ED, Stewart JA, Hott CE. La sécurité et l’efficacité du timolol 0,5% dans la gomme de xanthane par rapport à la solution gélifiée de timolol 0,5%. Curr Eye Res. 2002 May;24(5):387-91.
19. Fiscella RG, Gaynes BI, Jensen M. Equivalence des produits ophtalmiques génériques et de marque. Am J Health Syst Pharm. 2001 Apr 1;58(7):616-7.
20. Allergan Medical Affairs. Information médicale sur les gouttes ophtalmiques Prednisolone Forte. Irvine, CA, communication datée du 19 décembre 2011.
21. Roberts CW, Nelson PL. Analyse comparative des suspensions d’acétate de prednisolone. J Ocul Pharmacol Ther. 2007 Apr;23(2):182-7.
22. King DR, Kanavos P. Encourager l’utilisation de médicaments génériques : implications pour les économies de transition. Croat Med J. 2002 Aug;43(4):462-9.
23. Compte rendu de la réunion du Comité consultatif des consommateurs (CCC) de PHARMAC, 13 juillet 2007 ; Wellington, Nouvelle-Zélande. Disponible sur : www.pharmac.govt.nz/pdf/021007a.pdf (consulté en janvier 2012).
24. Pharmaceutical Research and Manufacturers of America. Communiqué de presse : R&D Les investissements des sociétés biopharmaceutiques américaines ont atteint des niveaux records en 2010. 15 mars 2011 ; Washington, D.C. Disponible à l’adresse suivante : www.phrma.org/media/releases/rd-investment-us-biopharmaceutical-companies-reached-record-levels-2010 (consulté en janvier 2012).