Température centraleModifier

Les mammifères régulent leur température centrale à l’aide d’entrées provenant de thermorécepteurs situés dans l’hypothalamus, le cerveau, la moelle épinière, les organes internes et les grandes veines. Outre la régulation interne de la température, un processus appelé allostasie peut entrer en jeu et ajuster le comportement pour s’adapter au défi des extrêmes très chauds ou froids (et à d’autres défis). Ces ajustements peuvent inclure la recherche de l’ombre et la réduction de l’activité, ou la recherche de conditions plus chaudes et l’augmentation de l’activité, ou encore le recroquevillement.La thermorégulation comportementale prend le pas sur la thermorégulation physiologique car les changements nécessaires peuvent être affectés plus rapidement et la thermorégulation physiologique est limitée dans sa capacité à répondre aux températures extrêmes.
Lorsque la température centrale chute, l’apport sanguin à la peau est réduit par une vasoconstriction intense. Le flux sanguin vers les membres (qui ont une grande surface) est réduit de manière similaire, et renvoyé vers le tronc via les veines profondes qui se trouvent à côté des artères (formant des venae comitantes). Il s’agit d’un système d’échange à contre-courant qui court-circuite la chaleur du sang artériel directement dans le sang veineux qui retourne dans le tronc, ce qui entraîne une perte de chaleur minimale des extrémités par temps froid. Les veines sous-cutanées des membres sont fortement rétrécies, ce qui non seulement réduit la perte de chaleur à partir de cette source, mais force également le sang veineux à entrer dans le système à contre-courant dans la profondeur des membres.
Le taux métabolique est augmenté, initialement par la thermogenèse non frissonnante, suivie par la thermogenèse frissonnante si les réactions précédentes sont insuffisantes pour corriger l’hypothermie.
Lorsque l’élévation de la température centrale est détectée par les thermorécepteurs, les glandes sudoripares de la peau sont stimulées par les nerfs sympathiques cholinergiques pour sécréter de la sueur sur la peau qui, en s’évaporant, refroidit la peau et le sang qui la traverse. L’halètement est un effecteur alternatif chez de nombreux vertébrés, qui refroidit le corps également par l’évaporation de l’eau, mais cette fois au niveau des muqueuses de la gorge et de la bouche.
GlycémieModification

La glycémie est régulée dans des limites assez étroites. Chez les mammifères, les principaux capteurs de cette régulation sont les cellules bêta des îlots pancréatiques. Les cellules bêta répondent à une augmentation du taux de sucre dans le sang en sécrétant de l’insuline dans le sang, et en empêchant simultanément leurs cellules alpha voisines de sécréter du glucagon dans le sang. Cette combinaison (taux élevé d’insuline dans le sang et faible taux de glucagon) agit sur les tissus effecteurs, dont les principaux sont le foie, les cellules graisseuses et les cellules musculaires. Le foie est empêché de produire du glucose, il l’absorbe et le transforme en glycogène et en triglycérides. Le glycogène est stocké dans le foie, mais les triglycérides sont sécrétés dans le sang sous forme de particules de lipoprotéines de très faible densité (VLDL) qui sont absorbées par le tissu adipeux, où elles sont stockées sous forme de graisses. Les cellules adipeuses absorbent le glucose grâce à des transporteurs de glucose spéciaux (GLUT4), dont le nombre dans la paroi cellulaire augmente sous l’effet direct de l’action de l’insuline sur ces cellules. Le glucose qui pénètre ainsi dans les cellules adipeuses est transformé en triglycérides (par les mêmes voies métaboliques que celles utilisées par le foie), puis stocké dans ces cellules adipeuses avec les triglycérides dérivés des VLDL qui ont été fabriqués dans le foie. Les cellules musculaires absorbent également le glucose par l’intermédiaire des canaux de glucose GLUT4 sensibles à l’insuline, et le transforment en glycogène musculaire.
Une baisse de la glycémie, entraîne l’arrêt de la sécrétion d’insuline, et la sécrétion de glucagon par les cellules alpha dans le sang. Cela inhibe l’absorption du glucose du sang par le foie, les cellules graisseuses et les muscles. Au lieu de cela, le foie est fortement stimulé pour fabriquer du glucose à partir du glycogène (par la glycogénolyse) et de sources non glucidiques (comme le lactate et les acides aminés désaminés) selon un processus connu sous le nom de gluconéogenèse. Le glucose ainsi produit est déversé dans le sang et corrige l’erreur détectée (hypoglycémie). Le glycogène stocké dans les muscles reste dans les muscles, et n’est décomposé, pendant l’exercice, qu’en glucose-6-phosphate et de là en pyruvate pour être introduit dans le cycle de l’acide citrique ou transformé en lactate. Seuls le lactate et les déchets du cycle de l’acide citrique sont renvoyés dans le sang. Le foie ne peut absorber que le lactate et, par le processus de gluconéogenèse consommateur d’énergie, le retransformer en glucose.
Niveaux de ferModification
Régulation du cuivreModification
Les niveaux de gaz du sangModifier
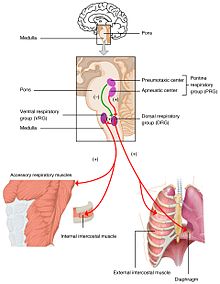
Les variations des taux d’oxygène, de dioxyde de carbone et du pH plasmatique sont envoyées au centre respiratoire, dans le tronc cérébral, où elles sont régulées.La pression partielle d’oxygène et de dioxyde de carbone dans le sang artériel est surveillée par les chimiorécepteurs périphériques (PNS) de l’artère carotide et de la crosse aortique. Une modification de la pression partielle du dioxyde de carbone est détectée comme une modification du pH du liquide céphalorachidien par les chimiorécepteurs centraux (CNS) situés dans le bulbe rachidien du tronc cérébral. Les informations provenant de ces ensembles de capteurs sont envoyées au centre respiratoire qui active les organes effecteurs – le diaphragme et les autres muscles de la respiration. Une augmentation du taux de dioxyde de carbone dans le sang, ou une diminution du taux d’oxygène, entraînera une respiration plus profonde et une augmentation de la fréquence respiratoire pour ramener les gaz sanguins à l’équilibre.
Une quantité trop faible de dioxyde de carbone et, dans une moindre mesure, une quantité trop importante d’oxygène dans le sang peuvent interrompre temporairement la respiration, un état connu sous le nom d’apnée, que les apnéistes utilisent pour prolonger le temps qu’ils peuvent rester sous l’eau.
La pression partielle du dioxyde de carbone est plutôt un facteur déterminant dans la surveillance du pH. Cependant, à haute altitude (au-dessus de 2500 m), la surveillance de la pression partielle de l’oxygène est prioritaire, et l’hyperventilation permet de maintenir le niveau d’oxygène constant. Avec le niveau plus faible de dioxyde de carbone, pour maintenir le pH à 7,4, les reins sécrètent des ions hydrogène dans le sang et excrètent du bicarbonate dans l’urine. Ceci est important dans l’acclimatation à la haute altitude.
Contenu en oxygène du sangModification
Les reins mesurent le contenu en oxygène plutôt que la pression partielle de l’oxygène dans le sang artériel. Lorsque la teneur en oxygène du sang est chroniquement basse, les cellules sensibles à l’oxygène sécrètent de l’érythropoïétine (EPO) dans le sang. Le tissu effecteur est la moelle osseuse rouge qui produit des globules rouges (GR)(érythrocytes). L’augmentation des globules rouges entraîne une augmentation de l’hématocrite dans le sang, puis une augmentation de l’hémoglobine qui accroît la capacité de transport de l’oxygène. C’est le mécanisme par lequel les habitants de haute altitude ont des hématocrites plus élevés que ceux du niveau de la mer, et aussi pourquoi les personnes souffrant d’insuffisance pulmonaire ou de shunts droite-gauche dans le cœur (par lesquels le sang veineux contourne les poumons et passe directement dans la circulation systémique) ont des hématocrites également élevés.
Qu’importe la pression partielle d’oxygène dans le sang, la quantité d’oxygène qui peut être transportée, dépend de la teneur en hémoglobine. La pression partielle d’oxygène peut être suffisante par exemple en cas d’anémie, mais la teneur en hémoglobine sera insuffisante et par la suite tout comme la teneur en oxygène. Compte tenu d’un apport suffisant en fer, en vitamine B12 et en acide folique, l’EPO peut stimuler la production de GR, et le contenu en hémoglobine et en oxygène rétabli à la normale.
Tension artérielleModification
Le cerveau peut réguler le débit sanguin sur une gamme de valeurs de pression artérielle par la vasoconstriction et la vasodilatation des artères.
Des récepteurs de haute pression appelés barorécepteurs dans les parois de la crosse aortique et du sinus carotidien (au début de l’artère carotide interne) surveillent la pression artérielle. Une augmentation de la pression est détectée lorsque les parois des artères s’étirent en raison d’une augmentation du volume sanguin. Les cellules du muscle cardiaque sécrètent alors dans le sang une hormone, le peptide natriurétique auriculaire (PNA). Cette hormone agit sur les reins en inhibant la sécrétion de rénine et d’aldostérone, ce qui entraîne la libération de sodium et d’eau dans l’urine, réduisant ainsi le volume sanguin.Cette information est ensuite transmise, par des fibres nerveuses afférentes, au noyau solitaire situé dans le bulbe rachidien. Cette information est ensuite transmise, par des fibres nerveuses afférentes, au noyau solitaire situé dans le bulbe rachidien. De là, les nerfs moteurs appartenant au système nerveux autonome sont stimulés pour influencer l’activité du cœur et des artères de plus petit diamètre, appelées artérioles. Les artérioles sont les principaux vaisseaux de résistance de l’arbre artériel, et de petites variations de diamètre entraînent de grandes variations de la résistance à l’écoulement à travers elles. Lorsque la pression artérielle augmente, les artérioles sont stimulées pour se dilater, ce qui permet au sang de quitter plus facilement les artères, ce qui les dégonfle et ramène la pression artérielle à la normale. Dans le même temps, le cœur est stimulé par les nerfs parasympathiques cholinergiques pour battre plus lentement (appelé bradycardie), assurant que l’entrée de sang dans les artères est réduite, ajoutant ainsi à la réduction de la pression, et à la correction de l’erreur initiale.
Une faible pression dans les artères, provoque le réflexe inverse de constriction des artérioles, et une accélération de la fréquence cardiaque (appelée tachycardie). Si la baisse de la pression artérielle est très rapide ou excessive, le bulbe rachidien stimule la médullosurrénale, via les nerfs sympathiques « préganglionnaires », pour qu’elle sécrète de l’épinéphrine (adrénaline) dans le sang. Cette hormone renforce la tachycardie et provoque une vasoconstriction sévère des artérioles de tous les organes du corps, à l’exception des organes essentiels (en particulier le cœur, les poumons et le cerveau). Ces réactions corrigent généralement très efficacement la faible pression artérielle (hypotension).
Niveaux de calciumModification

La concentration plasmatique en calcium ionisé (Ca2+) est très étroitement contrôlée par une paire de mécanismes homéostatiques. Le capteur du premier est situé dans les glandes parathyroïdes, où les cellules principales détectent le niveau de Ca2+ au moyen de récepteurs de calcium spécialisés dans leurs membranes. Les capteurs du second sont les cellules parafolliculaires de la glande thyroïde. Les cellules chefs parathyroïdiennes sécrètent l’hormone parathyroïdienne (PTH) en réponse à une baisse du taux de calcium ionisé plasmatique ; les cellules parafolliculaires de la glande thyroïde sécrètent la calcitonine en réponse à une augmentation du taux de calcium ionisé plasmatique.
Les organes effecteurs du premier mécanisme homéostatique sont les os, le rein et, via une hormone libérée dans le sang par le rein en réponse à des taux élevés de PTH dans le sang, le duodénum et le jéjunum. L’hormone parathyroïdienne (en concentration élevée dans le sang) provoque la résorption osseuse, en libérant du calcium dans le plasma. Il s’agit d’une action très rapide qui peut corriger une hypocalcémie menaçante en quelques minutes. Des concentrations élevées de PTH provoquent l’excrétion d’ions phosphate par l’urine. Comme les phosphates se combinent aux ions calcium pour former des sels insolubles (voir également minéral osseux), une diminution du taux de phosphates dans le sang libère des ions calcium libres dans le pool de calcium ionisé du plasma. La PTH a une deuxième action sur les reins. Elle stimule la fabrication et la libération, par les reins, de calcitriol dans le sang. Cette hormone stéroïde agit sur les cellules épithéliales de la partie supérieure de l’intestin grêle, augmentant leur capacité à absorber le calcium du contenu intestinal dans le sang.
Le second mécanisme homéostatique, dont les capteurs sont situés dans la glande thyroïde, libère de la calcitonine dans le sang lorsque le calcium ionisé sanguin augmente. Cette hormone agit principalement sur les os, provoquant l’élimination rapide du calcium du sang et son dépôt, sous forme insoluble, dans les os.
Les deux mécanismes homéostatiques fonctionnant par l’intermédiaire de la PTH d’une part, et de la calcitonine d’autre part, peuvent corriger très rapidement toute erreur imminente du taux de calcium ionisé plasmatique, soit en éliminant le calcium du sang et en le déposant dans le squelette, soit en éliminant le calcium de celui-ci. Le squelette agit comme une réserve de calcium extrêmement importante (environ 1 kg) par rapport à la réserve de calcium plasmatique (environ 180 mg). La régulation à plus long terme se fait par l’absorption ou la perte de calcium par l’intestin.
Un autre exemple sont les endocannabinoïdes les mieux caractérisés comme l’anandamide (N-arachidonoyléthanolamide ; AEA) et le 2-arachidonoylglycérol (2-AG), dont la synthèse se produit par l’action d’une série d’enzymes intracellulaires activées en réponse à une augmentation des niveaux de calcium intracellulaire pour introduire l’homéostasie et la prévention du développement tumoral par des mécanismes protecteurs putatifs qui empêchent la croissance et la migration cellulaire par l’activation des récepteurs CB1 et/ou CB2 et des récepteurs adjacents.
Concentration de sodiumModifier
Le mécanisme homéostatique qui contrôle la concentration plasmatique en sodium est plutôt plus complexe que la plupart des autres mécanismes homéostatiques décrits sur cette page.
Le capteur est situé dans l’appareil juxtaglomérulaire des reins, qui détecte la concentration plasmatique en sodium d’une manière étonnamment indirecte. Au lieu de la mesurer directement dans le sang qui passe devant les cellules juxtaglomérulaires, ces cellules répondent à la concentration de sodium dans le liquide tubulaire rénal après qu’il ait déjà subi une certaine modification dans le tubule contourné proximal et l’anse de Henle. Ces cellules répondent également au débit sanguin dans l’appareil juxtaglomérulaire, qui, dans des circonstances normales, est directement proportionnel à la pression artérielle, ce qui fait de ce tissu un capteur auxiliaire de la pression artérielle.
En réponse à une baisse de la concentration plasmatique en sodium, ou à une baisse de la pression artérielle, les cellules juxtaglomérulaires libèrent de la rénine dans le sang. La rénine est une enzyme qui clive un décapeptide (une courte chaîne protéique de 10 acides aminés) d’une α-2-globuline plasmatique appelée angiotensinogène. Ce décapeptide est connu sous le nom d’angiotensine I. Il n’a aucune activité biologique connue. Cependant, lorsque le sang circule dans les poumons, une enzyme endothéliale des capillaires pulmonaires appelée enzyme de conversion de l’angiotensine (ECA) clive deux autres acides aminés de l’angiotensine I pour former un octapeptide appelé angiotensine II. L’angiotensine II est une hormone qui agit sur le cortex surrénalien, provoquant la libération dans le sang d’une hormone stéroïde, l’aldostérone. L’angiotensine II agit également sur les muscles lisses des parois des artérioles, provoquant la constriction de ces vaisseaux de petit diamètre, ce qui restreint l’écoulement du sang de l’arbre artériel et entraîne une augmentation de la pression artérielle. Cela renforce donc les mesures décrites ci-dessus (sous le titre « Pression artérielle »), qui défendent la pression artérielle contre les changements, notamment l’hypotension.
L’aldostérone stimulée par l’angiotensine II et libérée par la zone glomérulaire des glandes surrénales a un effet sur les cellules épithéliales des tubules contournés distaux et des canaux collecteurs des reins en particulier. Elle y provoque la réabsorption des ions sodium du liquide tubulaire rénal, en échange des ions potassium qui sont sécrétés du plasma sanguin dans le liquide tubulaire pour quitter l’organisme via l’urine. La réabsorption des ions sodium du liquide tubulaire rénal arrête les pertes supplémentaires d’ions sodium de l’organisme et empêche donc l’aggravation de l’hyponatrémie. L’hyponatrémie ne peut être corrigée que par la consommation de sel dans l’alimentation. Cependant, il n’est pas certain qu’une « faim de sel » puisse être initiée par l’hyponatrémie, ni par quel mécanisme cela pourrait se produire.
Lorsque la concentration plasmatique en ions sodium est supérieure à la normale (hypernatrémie), la libération de rénine par l’appareil juxtaglomérulaire est stoppée, ce qui cesse la production d’angiotensine II et la libération d’aldostérone qui en découle dans le sang. Les reins réagissent en excrétant des ions sodium dans l’urine, normalisant ainsi la concentration plasmatique en ions sodium. Les faibles niveaux d’angiotensine II dans le sang abaissent la pression artérielle comme une réponse concomitante inévitable.
La réabsorption des ions sodium du liquide tubulaire suite à des niveaux élevés d’aldostérone dans le sang ne provoque pas, en soi, le retour de l’eau tubulaire rénale dans le sang à partir des tubules contournés distaux ou des canaux collecteurs. En effet, le sodium est réabsorbé en échange du potassium et ne provoque donc qu’un changement modeste du gradient osmotique entre le sang et le liquide tubulaire. En outre, l’épithélium des tubules contournés distaux et des canaux collecteurs est imperméable à l’eau en l’absence d’hormone antidiurétique (ADH) dans le sang. L’ADH fait partie du contrôle de l’équilibre hydrique. Son taux dans le sang varie en fonction de l’osmolalité du plasma, qui est mesurée dans l’hypothalamus du cerveau. L’action de l’aldostérone sur les tubules rénaux empêche la perte de sodium dans le liquide extracellulaire (LEC). Il n’y a donc pas de modification de l’osmolalité du liquide extracellulaire, et donc pas de modification de la concentration d’ADH dans le plasma. Cependant, un faible taux d’aldostérone entraîne une perte d’ions sodium dans le FEC, ce qui pourrait potentiellement entraîner une modification de l’osmolalité extracellulaire et donc du taux d’ADH dans le sang.
Concentration de potassiumModification
Des concentrations élevées de potassium dans le plasma provoquent une dépolarisation des membranes des cellules de la zona glomerulosa dans la couche externe du cortex surrénalien. Cela provoque la libération d’aldostérone dans le sang.
L’aldostérone agit principalement sur les tubules contournés distaux et les canaux collecteurs des reins, en stimulant l’excrétion des ions potassium dans l’urine. Elle le fait cependant en activant les pompes Na+/K+ basolatérales des cellules épithéliales tubulaires. Ces échangeurs sodium/potassium pompent trois ions sodium hors de la cellule, dans le liquide interstitiel et deux ions potassium dans la cellule à partir du liquide interstitiel. Cela crée un gradient de concentration ionique qui entraîne la réabsorption des ions sodium (Na+) du fluide tubulaire vers le sang, et la sécrétion des ions potassium (K+) du sang vers l’urine (lumière du canal collecteur).
Équilibre hydriqueModifier
La quantité totale d’eau dans le corps doit être maintenue en équilibre. L’équilibre hydrique implique de maintenir le volume de liquide stabilisé, et également de maintenir les niveaux d’électrolytes dans le liquide extracellulaire stables. L’équilibre hydrique est maintenu par le processus d’osmorégulation et par le comportement. La pression osmotique est détectée par des osmorécepteurs situés dans le noyau préoptique médian de l’hypothalamus. La mesure de l’osmolalité plasmatique pour donner une indication de la teneur en eau de l’organisme repose sur le fait que les pertes d’eau de l’organisme (par les inévitables pertes d’eau à travers la peau qui n’est pas entièrement imperméable et donc toujours légèrement humide, la vapeur d’eau dans l’air expiré, la transpiration, les vomissements, les selles normales et surtout la diarrhée) sont toutes hypotoniques, c’est-à-dire qu’elles sont moins salées que les liquides organiques (comparez, par exemple, le goût de la salive avec celui des larmes. Cette dernière a presque la même teneur en sel que le liquide extracellulaire, alors que la première est hypotonique par rapport au plasma. La salive n’a pas un goût salé, alors que les larmes sont résolument salées). Presque toutes les pertes normales et anormales d’eau corporelle entraînent donc une hypertonie du liquide extracellulaire. À l’inverse, un apport excessif de liquide dilue le liquide extracellulaire, ce qui amène l’hypothalamus à enregistrer des conditions d’hyponatrémie hypotonique.
Lorsque l’hypothalamus détecte un environnement extracellulaire hypertonique, il provoque la sécrétion d’une hormone antidiurétique (ADH) appelée vasopressine qui agit sur l’organe effecteur, qui est dans ce cas le rein. L’effet de la vasopressine sur les tubules rénaux est de réabsorber l’eau des tubules contournés distaux et des canaux collecteurs, empêchant ainsi l’aggravation de la perte d’eau par l’urine. L’hypothalamus stimule simultanément le centre de la soif situé à proximité, provoquant une envie presque irrésistible (si l’hypertonie est suffisamment grave) de boire de l’eau. L’arrêt du débit urinaire empêche l’hypovolémie et l’hypertonicité de s’aggraver ; la consommation d’eau corrige le défaut.
L’hypo-osmolalité se traduit par des taux plasmatiques d’ADH très bas. Il en résulte une inhibition de la réabsorption de l’eau au niveau des tubules rénaux, provoquant l’excrétion de volumes élevés d’urine très diluée, ce qui permet de se débarrasser de l’excès d’eau dans l’organisme.
La perte d’eau urinaire, lorsque l’homéostat hydrique de l’organisme est intact, est une perte d’eau compensatoire, corrigeant tout excès d’eau dans l’organisme. Cependant, comme les reins ne peuvent pas générer d’eau, le réflexe de soif est le deuxième mécanisme effecteur très important de l’homéostat hydrique corporel, corrigeant tout déficit hydrique dans l’organisme.
Phédicament sanguin
Le pH plasmatique peut être modifié par des changements respiratoires de la pression partielle du dioxyde de carbone ; ou modifié par des changements métaboliques du rapport acide carbonique/ion bicarbonate. Le système tampon bicarbonate régule le rapport acide carbonique/bicarbonate pour qu’il soit égal à 1:20, rapport auquel le pH sanguin est de 7,4 (comme l’explique l’équation de Henderson-Hasselbalch). Une modification du pH plasmatique entraîne un déséquilibre acide-base. Dans l’homéostasie acide-base, deux mécanismes peuvent aider à réguler le pH. La compensation respiratoire, un mécanisme du centre respiratoire, ajuste la pression partielle du dioxyde de carbone en modifiant le rythme et la profondeur de la respiration, afin de ramener le pH à la normale. La pression partielle du dioxyde de carbone détermine également la concentration d’acide carbonique, et le système tampon du bicarbonate peut également entrer en jeu. La compensation rénale peut aider le système tampon bicarbonate.Le capteur de la concentration plasmatique de bicarbonate n’est pas connu avec certitude. Il est très probable que les cellules tubulaires rénales des tubules contournés distaux soient elles-mêmes sensibles au pH du plasma. Le métabolisme de ces cellules produit du dioxyde de carbone, qui est rapidement converti en hydrogène et en bicarbonate par l’action de l’anhydrase carbonique. Lorsque le pH du FEC diminue (devenant plus acide), les cellules tubulaires rénales excrètent des ions hydrogène dans le liquide tubulaire pour quitter l’organisme via l’urine. Des ions bicarbonate sont simultanément sécrétés dans le sang, ce qui diminue l’acide carbonique et, par conséquent, augmente le pH plasmatique. L’inverse se produit lorsque le pH plasmatique s’élève au-dessus de la normale : les ions bicarbonate sont excrétés dans l’urine, et les ions hydrogène libérés dans le plasma.
Lorsque les ions hydrogène sont excrétés dans l’urine, et le bicarbonate dans le sang, ce dernier se combine avec les ions hydrogène en excès dans le plasma qui ont stimulé les reins à effectuer cette opération. La réaction qui en résulte dans le plasma est la formation d’acide carbonique qui est en équilibre avec la pression partielle du dioxyde de carbone dans le plasma. Celle-ci est étroitement régulée afin de garantir qu’il n’y ait pas d’accumulation excessive d’acide carbonique ou de bicarbonate. L’effet global est donc que les ions hydrogène sont perdus dans l’urine lorsque le pH du plasma diminue. L’augmentation concomitante du bicarbonate plasmatique absorbe l’augmentation des ions hydrogène (causée par la baisse du pH plasmatique) et l’excès d’acide carbonique qui en résulte est éliminé dans les poumons sous forme de dioxyde de carbone. Le rapport normal entre le bicarbonate et la pression partielle du dioxyde de carbone, et donc le pH plasmatique, est ainsi rétabli. L’inverse se produit lorsqu’un pH plasmatique élevé stimule les reins à sécréter des ions hydrogène dans le sang et à excréter du bicarbonate dans l’urine. Les ions hydrogène se combinent avec les ions bicarbonate en excès dans le plasma, formant à nouveau un excès d’acide carbonique qui peut être expiré, sous forme de dioxyde de carbone, dans les poumons, ce qui maintient constants la concentration d’ions bicarbonate dans le plasma, la pression partielle du dioxyde de carbone et, par conséquent, le pH plasmatique.
Fluide céphalo-rachidienModification
Le liquide céphalo-rachidien (LCR) permet de réguler la distribution des substances entre les cellules du cerveau, et les facteurs neuroendocriniens, auxquels de légères modifications peuvent causer des problèmes ou des dommages au système nerveux. Par exemple, une concentration élevée de glycine perturbe le contrôle de la température et de la pression artérielle, et un pH élevé du LCR provoque des vertiges et des syncopes.
NévrotransmissionEdit
Les neurones inhibiteurs du système nerveux central jouent un rôle homéostatique dans l’équilibre de l’activité neuronale entre excitation et inhibition. Les neurones inhibiteurs utilisant le GABA, effectuent des changements compensatoires dans les réseaux neuronaux empêchant l’emballement des niveaux d’excitation. On constate qu’un déséquilibre entre excitation et inhibition est impliqué dans un certain nombre de troubles neuropsychiatriques.
Système neuroendocrinienEdit
Le système neuroendocrinien est le mécanisme par lequel l’hypothalamus maintient l’homéostasie, en régulant le métabolisme, la reproduction, le comportement alimentaire et de boisson, l’utilisation de l’énergie, l’osmolarité et la pression artérielle.
La régulation du métabolisme, s’effectue par des interconnexions hypothalamiques avec d’autres glandes. Trois glandes endocrines de l’axe hypothalamo-hypophyso-gonadique (axe HPG) travaillent souvent ensemble et ont des fonctions régulatrices importantes. Deux autres axes endocriniens régulateurs sont l’axe hypothalamo-hypophyso-surrénalien (axe HPA) et l’axe hypothalamo-hypophyso-thyroïdien (axe HPT).
Le foie a également de nombreuses fonctions régulatrices du métabolisme. Une fonction importante est la production et le contrôle des acides biliaires. Un excès d’acide biliaire peut être toxique pour les cellules et sa synthèse peut être inhibée par l’activation de FXR un récepteur nucléaire.
Régulation des gènesModification
Au niveau cellulaire, l’homéostasie est assurée par plusieurs mécanismes dont la régulation transcriptionnelle qui peut modifier l’activité des gènes en réponse à des changements.
Balance énergétiqueEdit
La quantité d’énergie absorbée par la nutrition doit correspondre à la quantité d’énergie utilisée. Pour atteindre l’homéostasie énergétique, l’appétit est régulé par deux hormones, la grehline et la leptine. La grehline stimule la faim et la prise d’aliments, tandis que la leptine agit pour signaler la satiété (plénitude).
Un examen de 2019 des interventions visant à modifier le poids, y compris les régimes, l’exercice physique et la suralimentation, a révélé que l’homéostasie du poids corporel ne pouvait pas corriger précisément les « erreurs énergétiques », c’est-à-dire la perte ou le gain de calories, à court terme.