Nous savons tous très bien ce qu’est la chaleur et ce qu’elle est capable de faire. Mais, la chaleur spécifique est un concept que très peu de gens connaissent. Aussi, nous utilisons la chaleur spécifique pour augmenter la température d’un objet par degré. Dans cette rubrique, nous aborderons la chaleur spécifique, la formule de la chaleur spécifique, sa dérivation et des exemples résolus. En outre, la chaleur spécifique de différents éléments diffère les uns des autres.
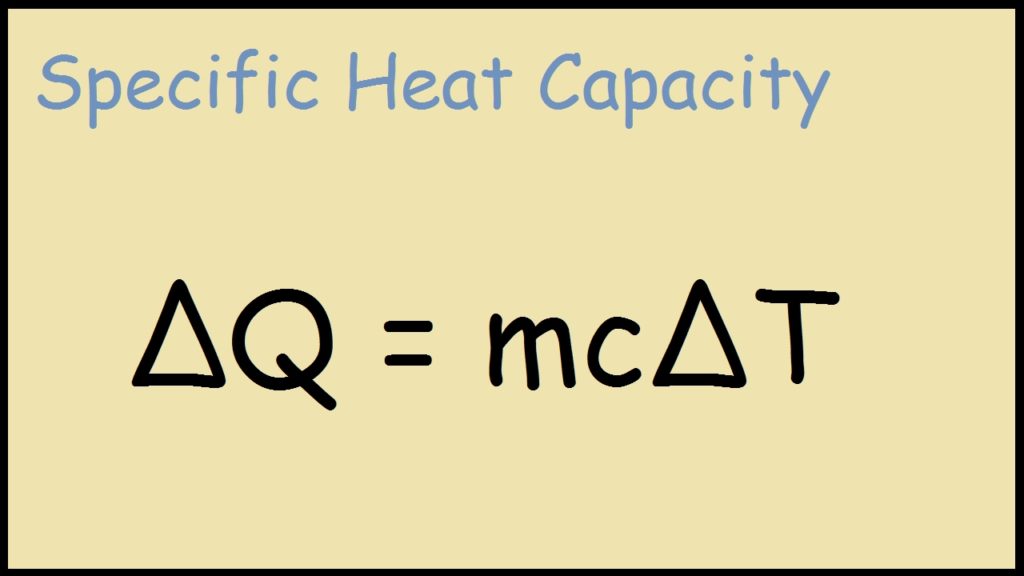
Source : YouTube
Chaleur spécifique
La chaleur spécifique désigne le rapport entre la quantité de chaleur dont nous avons besoin pour augmenter d’un degré la température d’un corps et celle dont nous avons besoin pour augmenter d’un degré la température d’une masse équivalente de liquide (eau). Aussi, nous utilisons le terme dans un sens plus étroit pour désigner la quantité de chaleur, en calories, dont nous avons besoin pour élever la température d’un gramme d’une substance d’un degré Celsius.
En termes simples, c’est le rapport entre la quantité de chaleur nécessaire pour augmenter la température d’un objet d’un degré et la quantité de chaleur nécessaire pour augmenter la température de la même quantité d’eau d’un degré.
Get the huge list of Physics Formulas here
Formule de la chaleur spécifique
Comme nous l’avons discuté ci-dessus, la chaleur spécifique est la relation du changement de température d’un objet avec l’eau.
Aussi, la formule est la suivante :
Énergie calorifique = (masse de l’objet ou de la substance) × (chaleur spécifique) × (changement de température)
Q = m × c × \(\Delta T\)
Or
Q = \(mc\Delta T\)
Dérivation de la formule de la chaleur spécifique
Exemples résolus sur la formule de la chaleur spécifique
Exemple 1
Si la chaleur spécifique de l’or est de 129 \(J/kg\cdot k\). Alors quelle quantité d’énergie thermique est nécessaire pour augmenter la température de 100 g d’or de 50,0 K ?
Solution:
Calcul:
Q = \(mc\Delta T\)
Q = (0,100 kg) (129 \(J/kg\cdot k\)). (50,0 K)
Donc, l’énergie nécessaire pour élever la température de 100 g d’or est de 645 J.
Exemple 2
Supposons qu’une casserole soit chauffée en transférant 1676 KJ d’énergie thermique à l’eau. De plus, s’il y a 5,000 kg d’eau dans la casserole et que la température est augmentée de 80,0 K, alors trouvez la chaleur spécifique de l’eau ?
Solution:
Ecrivons les choses données dans la question
Masse (m) = 5,00 kg
Température (T) = 80.0 K
Chaleur spécifique (c) = 1676 KJ
Maintenant, nous devons convertir la chaleur spécifique en Joules car elle est en Kilojoules.
Donc, la conversion est comme ceci
1 KJ = 1 000 J
Donc, 1676 KJ = 1 000 × 1676 = 16 76 000 J
Maintenant, mettez toutes les valeurs dans la formule. Mais, avant cela, nous devons réorganiser la formule pour trouver la chaleur spécifique.
Q = \(mc\Delta T\) \(\rightarrow\) c = \(\frac{Q}{m\Delta T}\)
Maintenant mettre les valeurs dans la formule réarrangée
C = \(\frac{1676000} {(5.00 kg)(80,0)}\)
C = 4190 \(J/kg\cdot k\)
Donc, la chaleur spécifique de l’eau est de 4190 \(J/kg\cdot k\).
.