L’élément chimique césium est classé parmi les métaux alcalins. Il a été découvert en 1860 par Robert Bunsen et Gustav Kirchhoff.

Zone de données
| Classification : | Le césium est un métal alcalin | Couleur : | jaune/argenté | Poids atomique : | 132.9055 |
| État: | solide | ||||
| Point de fusion: | 28.4 oC , 301.6 K | Point d’ébullition : | 670 oC, 943.2 K | Electrons : | 55 |
| Protons : | 55 | ||||
| Neutrons dans l’isotope le plus abondant : | 78 | ||||
| Coquilles électroniques : | 2,8,18,18,8,1 | ||||
| Configuration électronique : | 6s1 | ||||
| Densité à 20oC : | 1.873 g/cm3 |
Afficher plus, notamment : Chaleurs, énergies, oxydation, réactions,
composés, rayons, conductivités
| Volume atomique: | 71.07 cm3/mol | Structure: | bcc : body-centered cubic | Dureté : | 0,2 mohs |
| Capacité thermique spécifique | 0,24 J g-1 K-1 | |
| Chaleur de fusion | 2.092 kJ mol-1 | |
| Chaleur d’atomisation | 76 kJ mol-1 | |
| Chaleur de vaporisation | 67.740 kJ mol-1 | 1ère énergie d’ionisation | 375,7 kJ mol-1 | 2ème énergie d’ionisation | 2234.3 kJ mol-1 | 3e énergie d’ionisation | 3400 kJ mol-1 |
| Affinité électronique | 45.506 kJ mol-1 | |
| Nombre d’oxydation minimal | 0 | |
| Min. nombre d’oxydation commun | 0 | |
| Nombre d’oxydation maximal | 3 | |
| Nombre d’oxydation commun maximal | . | 3 |
| Electronégativité (échelle de Pauling) | 0,79 | |
| Volume de polarisabilité | 59.6 Å3 | Réaction avec l’air | vive, ⇒ Cs2O |
| Réaction avec 15 M HNO3 | vive, ⇒ CsNO3 | Réaction avec 6 M HCl | vive, ⇒ H2, CsCl |
| Réaction avec 6 M NaOH | vive, ⇒ H2, CsOH | |
| Oxyde(s) | Cs2O, CsO2, Cs2O2 | Hydrure(s) | CsH | Chlorure(s) | CsCl | Rayon atomique | 260 pm | Rayon ionique (ion 1+) | . ionique (ion 1+) | 181 pm |
| Rayon ionique (ion 2+) | Rayon ionique (ion 3+) | |
| Rayon ionique (ion 1- ion) | – | |
| Rayon ionique (2- ion) | – | |
| Rayon ionique (3- ion) | – | |
| Conductivité thermique | 35.9 W m-1 K-1 | Conductivité électrique | 5,3 x 106 S m-1 | Point de congélation/fusion : | 28,4 oC , 301.6 K |

Cristaux de césium de haute pureté sous argon. Photo de Dennis S.K.
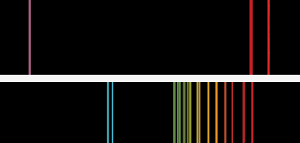
Spectres d’émission de flamme de base semblables à ceux que Bunsen et Kirchoff ont vus. Le spectre supérieur est celui du potassium, avec la ligne violette distinctive. Pour le césium, les lignes jumelles bleu ciel montrent qu’un nouvel élément était présent.
Découverte du césium
Le césium a été le premier élément découvert à l’aide d’un spectroscope.
Il a été découvert par Robert Bunsen et Gustav Kirchhoff en 1860 à Heidelberg, en Allemagne, lorsqu’ils ont analysé le spectre d’une eau minérale.
Un an plus tôt, Bunsen et Kirchhoff avaient mis au point le spectroscope. L’appareil était basé sur un prisme qui séparait la lumière d’une flamme en un arc-en-ciel de couleurs.
Dans chaque spectre qu’ils observaient, Bunsen et Kirchhoff trouvaient des lignes colorées. Ils ont réalisé que ces lignes étaient uniques à la substance brûlée.
En étudiant le spectre d’un résidu d’eau minérale de spa, ils ont trouvé une série de lignes colorées dans le spectre d’émission qui ne correspondaient à aucun élément connu.
Bunsen et Kirchhoff ont nommé l’élément césium, du mot latin « caesius » qui signifie bleu ciel, après les lignes bleues qu’ils ont vues dans le spectre.
L’orthographe latine se reflète encore dans l’anglais britannique où césium s’écrit ‘caesium’.’
En 1861, Bunsen et Kirchhoff ont également découvert le rubidium par la même méthode.


Horloge atomique au césium. Précision de 1 seconde en 300 millions d’années.
Apparence et caractéristiques
Effets nocifs :
Le césium doit être conservé sous un liquide/gaz inerte ou sous vide pour le protéger de l’air et de l’eau. Les composés du césium sont considérés comme légèrement toxiques.
Caractéristiques :
Le césium est un métal alcalin argenté, mou et ductile. Il est liquide dans une pièce chaude, fondant à 28,4 oC (83,1 oF).
Le césium est l’un des rares métaux à être liquide près de la température ambiante. Les autres sont le gallium, le francium et le mercure.
Le césium est un métal extrêmement réactif et le plus alcalin des éléments. Il réagit de manière explosive au contact de l’eau en produisant de l’hydroxyde de césium (CsOH), une base extrêmement forte qui peut rapidement corroder le verre.
Utilisations du césium
Le césium est utilisé dans les horloges atomiques, qui sont incroyablement précises. NIST-F2, le principal étalon de temps et de fréquence américain, est une horloge atomique à fontaine de césium développée dans les laboratoires du NIST à Boulder, dans le Colorado. NIST-F2 contribue au groupe international d’horloges atomiques qui définissent le temps universel coordonné (UTC), l’heure officielle du monde. Comme les scientifiques continuent à améliorer sa technologie, l’incertitude de la mesure du temps de NIST-F1 s’améliore continuellement. Actuellement, elle ne gagne ni ne perd autant d’une seconde en plus de 300 millions d’années. Voir aussi strontium.
Le césium est également utilisé dans les cellules photoélectriques et comme catalyseur dans l’hydrogénation des composés organiques. Le métal est utilisé comme » getter » dans les tubes à vide.
L’hydroxyde de césium est utilisé pour graver le silicium.
Abondance et isotopes
Abondance croûte terrestre : 3 parties par million en poids, 0.5 parties par million par moles
Abondance système solaire : 8 parties par milliard en poids, 70 parties par trillion par moles
Coût, pur : 1100 $ par 100g
Coût, en vrac : $ par 100g
Source : Le césium se trouve dans les minéraux pollucite et lépidolite. Sur le plan commercial, la plupart du césium est produit comme sous-produit de la production de lithium métal. Plus des deux tiers des réserves mondiales de césium – 110 000 tonnes – se trouvent à Bernic Lake, dans le Manitoba, au Canada.
Isotopes : Le césium possède 36 isotopes dont la demi-vie est connue, avec les numéros de masse 112 à 148. Le césium naturel est constitué de son seul isotope stable, le 133Cs.

Citer cette page
Pour un lien en ligne, veuillez copier et coller l’un des éléments suivants :
<a href="https://www.chemicool.com/elements/cesium.html">Cesium</a>
ou
<a href="https://www.chemicool.com/elements/cesium.html">Cesium Element Facts</a>
Pour citer cette page dans un document universitaire, veuillez utiliser la citation suivante conforme à la norme MLA :
"Cesium." Chemicool Periodic Table. Chemicool.com. 10 Nov. 2014. Web. <https://www.chemicool.com/elements/cesium.html>.
.