L’azote est essentiel à la vie sur Terre. C’est un composant de toutes les protéines, et on le trouve dans tous les systèmes vivants. Les composés azotés sont présents dans les matières organiques, les aliments, les engrais, les explosifs et les poisons. L’azote est crucial pour la vie, mais en excès, il peut aussi être nocif pour l’environnement.
Nommé d’après le mot grec nitron, pour « soude native », et genes pour « former », l’azote est le cinquième élément le plus abondant dans l’univers. L’azote gazeux constitue 78 % de l’air de la Terre, selon le laboratoire national de Los Alamos. En revanche, l’atmosphère de Mars ne contient que 2,6 % d’azote.
Sous sa forme gazeuse, l’azote est incolore, inodore et généralement considéré comme inerte. Sous sa forme liquide, l’azote est également incolore et inodore, et ressemble à l’eau, selon Los Alamos.
Les faits
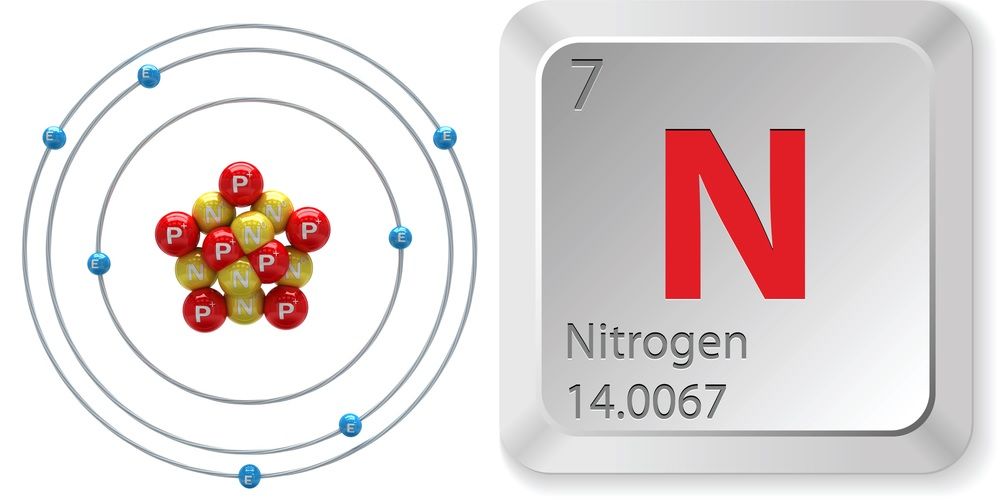
- Numéro atomique (nombre de protons dans le noyau) : 7
- Symbole atomique (sur le tableau périodique des éléments) : N
- Poids atomique (masse moyenne de l’atome) : 14,0067
- Densité : 0,0012506 gramme par centimètre cube
- Phase à température ambiante : Gaz
- Point de fusion : moins 321 degrés Fahrenheit (moins 210 degrés Celsius)
- Point d’ébullition : moins 320,42 F (moins 195,79 C)
- Nombre d’isotopes (atomes d’un même élément ayant un nombre différent de neutrons) : 16 dont 2 stables
- Isotopes les plus courants : Azote-14 (Abondance : 99.63 pour cent)
Composant de l’engrais
L’azote a été découvert en 1772 par le chimiste et médecin Daniel Rutherford, lorsqu’il a retiré l’oxygène et le dioxyde de carbone de l’air, démontrant que le gaz résiduel ne supporterait pas les organismes vivants ou la combustion, selon le Los Alamos National Laboratory. D’autres scientifiques, dont Carl Wilhelm Scheele et Joseph Priestly, travaillaient sur le même problème et appelaient l’azote l’air « brûlé », ou air sans oxygène. En 1786, Antoine Laurent de Lavoisier appelle l’azote « azote », ce qui signifie « sans vie ». Cela était basé sur l’observation que c’est la partie de l’air ne peut pas soutenir la vie sur son propre.
L’un des composés azotés les plus importants est l’ammoniac (NH3), qui peut être produit dans le processus dit Haber-Bosch, dans lequel l’azote réagit avec l’hydrogène. Le gaz ammoniac incolore à l’odeur piquante peut être facilement liquéfié en un engrais azoté. En fait, environ 80 % de l’ammoniac produit est utilisé comme engrais. Il est également utilisé comme gaz réfrigérant ; dans la fabrication de plastiques, de textiles, de pesticides et de colorants ; et dans les solutions de nettoyage, selon le Département d’État de New York.
Le cycle de l’azote
Le cycle de l’azote, dans lequel l’azote atmosphérique est converti en différents composés organiques, est l’un des processus naturels les plus cruciaux pour le maintien des organismes vivants. Au cours de ce cycle, les bactéries présentes dans le sol transforment ou « fixent » l’azote atmosphérique en ammoniac, dont les plantes ont besoin pour se développer. D’autres bactéries transforment l’ammoniac en acides aminés et en protéines. Ensuite, les animaux mangent les plantes et consomment les protéines. Les composés azotés retournent dans le sol par le biais des déchets animaux. Les bactéries reconvertissent l’azote des déchets en azote gazeux, qui retourne dans l’atmosphère.
Dans le but de faire pousser les cultures plus rapidement, les gens utilisent l’azote dans les engrais. Cependant, l’utilisation excessive de ces engrais dans l’agriculture a eu des conséquences dévastatrices pour l’environnement et la santé humaine, car elle a contribué à la pollution des eaux souterraines et de surface. Selon l’Agence américaine de protection de l’environnement (EPA), la pollution par les nutriments, causée par l’excès d’azote et de phosphore dans l’air et dans l’eau, est l’un des problèmes environnementaux les plus répandus, les plus coûteux et les plus difficiles à résoudre.
S’attaquer au déséquilibre
L’une des solutions au problème de l’excès d’azote réside dans l’agriculture durable, l’agriculture biologique et la sensibilisation des agriculteurs à ces problèmes environnementaux, selon Randy A. Dahlgren, professeur de science du sol à l’Université de Californie, Davis.
« L’idée serait d’essayer d’éliminer l’utilisation de ces engrais commerciaux et d’utiliser plutôt des déchets organiques », par exemple des déchets animaux, a-t-il déclaré. Une autre étape consisterait à utiliser des engrais à libération lente qui sont recouverts d’un revêtement en plastique et, au lieu de libérer l’azote tout de suite, la libération de l’azote se fait progressivement tout au long de la saison de croissance, « en essayant de faire correspondre la libération d’azote de l’engrais recouvert de plastique avec les besoins de la plante », a-t-il dit.
Des microbiologistes de l’Université d’Alberta au Canada et de l’Université de Vienne en Autriche pourraient avoir découvert une autre solution. En août 2017, les chercheurs ont annoncé avoir identifié un microbe oxydant l’ammoniac appelé Nitrospira inopinata.
Selon les chercheurs, Nitrospira inopinata est une éponge à ammonium, surpassant essentiellement presque tous les autres types de bactéries et d’archées (organismes unicellulaires) dans l’oxydation de l’ammonium dans l’environnement. Parce que ce microbe est un oxydant si efficace, il pourrait produire moins d’oxyde nitreux dans le processus.
Les nouvelles découvertes, qui apparaissent dans la revue scientifique Nature, pourraient avoir des implications importantes pour la recherche sur le changement climatique. Les chercheurs sont prêts à mettre ce microbe à l’épreuve à travers une variété d’applications pratiques qui pourraient réduire les niveaux d’ammonium dans le sol, l’eau et l’atmosphère. Certaines de ces applications pourraient impliquer des changements dans notre eau potable, le traitement des eaux usées et la purification des sols, selon l’Université de l’Alberta.
Qui l’aurait su ?
- Même si le terme « azote » est utilisé en anglais pour désigner l’élément, le terme « azote » de Lavoisier est toujours utilisé en français, et sa forme est présente dans « azoto » en italien ou « azot » en polonais.
- L’azote liquide est fréquemment utilisé comme réfrigérant, par exemple pour stocker le sperme, les œufs et d’autres cellules utilisées dans la recherche médicale ou les cliniques de fertilité, selon la Royal Society of Chemistry.
- L’azote liquide est également utilisé pour congeler rapidement les aliments et aider à préserver leur goût, leur texture, leur humidité et leur saveur.
- L’azote constitue 95 % de l’atmosphère de Titan (la plus grande lune de Saturne), selon le Jet Propulsion Laboratory.
- L’azote gazeux joue un rôle dans la formation d’une aurore – un spectacle naturel de lumière dans le ciel qui peut être observé principalement dans les régions arctiques et antarctiques – qui se produit lorsque des électrons se déplaçant rapidement depuis l’espace entrent en collision avec l’oxygène et l’azote dans notre atmosphère, selon la NASA.
- L’azote gazeux peut être obtenu en chauffant une solution aqueuse de nitrate d’ammonium (NH4NO3), un solide cristallin couramment utilisé dans les engrais.
- Environ 150 tonnes d’ammoniac sont produites chaque année par le procédé Haber, selon la Royal Society of Chemistry.
- L’azote sous forme de chlorure d’ammonium, NH4Cl, était produit dans l’Égypte ancienne en chauffant un mélange d’excréments d’animaux, d’urine et de sel, selon la Royal Society of Chemistry.
- La nitroglycérine, un explosif violent utilisé dans la production de dynamite, est un liquide huileux et incolore qui contient de l’azote, de l’oxygène et du carbone.
Rapport complémentaire de Traci Pedersen, collaboratrice de Live Science.