US Pharm. 2020;45(6):30-32.
ABSTRACT : La FDA définit un médicament générique comme un « médicament créé pour être identique à un médicament de marque déjà commercialisé en ce qui concerne la forme posologique, la sécurité, la force, la voie d’administration, la qualité, les caractéristiques de performance et l’utilisation prévue. » Le système de santé américain a économisé près de 2 000 milliards de dollars de 2009 à 2019 en coûts de soins de santé grâce à l’utilisation des génériques, avec des économies accrues chaque année. Malgré cette variation des coûts, des obstacles tels que le manque de communication et d’éducation, les effets secondaires antérieurs ou la préférence peuvent jouer un rôle dans la poursuite de l’utilisation des médicaments d’origine. L’augmentation du marché des produits génériques créera de la concurrence et, en fin de compte, entraînera une baisse des prix des médicaments et l’accès à des soins de santé abordables pour un plus grand nombre de patients. Il est important que les pharmaciens éduquent les patients et les fournisseurs sur l’utilisation appropriée des médicaments génériques par rapport aux médicaments de marque.
La FDA définit un médicament générique comme un « médicament créé pour être le même qu’un médicament de marque déjà commercialisé en termes de forme posologique, de sécurité, de force, de voie d’administration, de qualité, de caractéristiques de performance et d’utilisation prévue. « 1,2 Les médicaments génériques sont donc équivalents aux produits de marque en termes d’efficacité, de qualité et de sécurité. Les demandes abrégées de nouveaux médicaments (ANDA) pour l’approbation des génériques doivent démontrer la bioéquivalence et que l’ingrédient actif est le même que celui du nom de marque ; ils peuvent différer sur la base des ingrédients inactifs, mais il doit être prouvé que ces différences n’ont aucun effet sur la façon dont le médicament fonctionne1-3.
La loi de 1984 sur la concurrence des prix des médicaments et la restauration de la durée des brevets, ou loi Hatch-Waxman, a permis d’approuver l’utilisation des génériques sur le marché sans tests précliniques et cliniques pour garantir qu’un générique serait moins cher par rapport à son équivalent de marque. Les génériques ont un coût inférieur de 80 % à 85 % par rapport à leur produit de marque.1 Selon les données IQVIA 2019, le système de santé américain a économisé près de 2 000 milliards de dollars entre 2009 et 2019 grâce à l’utilisation des génériques, avec une augmentation des économies chaque année.4,5 Selon un rapport de l’Association of Accessible Medicines (AAM), 4 milliards d’ordonnances génériques ont été exécutées en 2018 aux États-Unis, ce qui représentait 90 % des ordonnances exécutées aux États-Unis. Cependant, cela ne représentait que 22 % de toutes les dépenses en médicaments.5
En raison de perceptions ou d’expériences passées avec les médicaments génériques, certains consommateurs continuent d’utiliser des médicaments de marque malgré cette différence de coût, ce qui peut entraîner une augmentation des dépenses de consommation, une insatisfaction des patients et, au final, une diminution de l’adhésion. Répondre aux questions ou discuter avec les patients de l’utilisation des médicaments génériques par rapport aux médicaments d’origine ou des ingrédients inactifs par rapport aux ingrédients actifs est un rôle important pour les pharmaciens afin d’aider à améliorer la satisfaction des patients, leur adhésion et leur qualité de vie. Avoir un marché accru de produits génériques créera de la concurrence et, en fin de compte, conduira à une baisse des prix des médicaments et à l’accès à des soins de santé abordables pour plus de patients.1
Points de discussion
En raison des idées fausses et du manque de compréhension de la différence entre les produits de marque et les produits génériques, il est vital d’éduquer les patients sur les faits. Soulignés dans les prochains paragraphes sont des concepts de discussion qui peuvent être importants pour nos patients.
Quelle est la différence entre les ingrédients actifs et inactifs?
Un ingrédient actif est le composant du médicament qui produit l’effet pharmacologique sur le corps. Les ingrédients actifs peuvent subir des modifications chimiques lors de la fabrication du produit et être présents sous une forme modifiée pour qu’il produise son effet.6 Un exemple de ceci serait une formulation à libération prolongée d’un médicament. Un ingrédient inactif est un composant du médicament qui n’affecte pas l’action thérapeutique du médicament sur le corps. Les ingrédients inactifs sont ajoutés à un produit pharmaceutique pour faciliter la liaison, l’aromatisation, la coloration, la conservation ou le transport du médicament. Des exemples choisis d’ingrédients inactifs sont l’alcool, la gélatine, le galactose, le lactose et la saccharine.
Pour obtenir l’approbation de la FDA, un médicament générique doit contenir le même ingrédient actif que le médicament d’origine (c’est-à-dire le produit de marque). Bien que les ingrédients inactifs puissent être différents, la FDA effectue régulièrement des examens approfondis des produits génériques pour s’assurer qu’ils répondent aux normes. La FDA comprend qu’il puisse y avoir une variabilité dans chaque lot fabriqué, mais l’ampleur de cette variabilité est limitée. Cette variabilité peut se produire entre les médicaments de marque et les génériques, mais elle peut également avoir lieu entre les marques, en raison de légères différences dans la fabrication des lots.1 La FDA enquête également sur les effets secondaires signalés avec un produit de marque ou générique pour déterminer si des modifications de fabrication sont nécessaires.
Quelle est la différence entre un produit générique et un générique autorisé ?
Un produit générique est l’équivalent d’un produit de marque fabriqué par une société distincte de celle qui fabrique le produit de marque. Un générique autorisé, cependant, peut être commercialisé par le fabricant du médicament de marque ou par une société avec l’autorisation de la marque, mais comme un générique à un coût inférieur. Les génériques autorisés sont les mêmes que le médicament de marque en ce sens qu’ils ont les mêmes ingrédients actifs et inactifs, mais leur apparence peut différer.7 Un générique autorisé peut ne pas figurer dans la liste des médicaments génériques de la FDA, connue sous le nom d’Orange Book, car il est commercialisé dans le cadre de la New Drug Application de la marque, contrairement aux produits génériques, qui sont approuvés après soumission d’une ANDA7,8.
Les génériques et les génériques autorisés peuvent être moins coûteux par rapport aux médicaments de marque, car les fabricants de génériques n’ont pas à réaliser les essais cliniques qui étaient nécessaires pour les produits de marque.
Y a-t-il quelque chose à surveiller lors du passage d’un produit de marque à un produit générique ?
Les médicaments de marque et les médicaments génériques ne sont pas autorisés à se ressembler, en raison des lois sur les marques commerciales aux États-Unis. Les différences de couleur, de forme, de taille et de saveur, cependant, ne jouent pas un rôle dans la façon dont les médicaments fonctionnent. Comme nous l’avons déjà dit, il existe une certaine variabilité dans les lots, mais à des niveaux très faibles et non significatifs. Par exemple, une grande étude comparant des médicaments génériques à des médicaments de marque a trouvé de petites différences de seulement 3,5 % dans l’absorption dans le corps entre les médicaments génériques et les médicaments de marque.9
Barrières possibles à la prescription de médicaments génériques et moyens de les surmonter
Des enquêtes et des études ont été menées au fil des ans pour analyser les barrières à l’utilisation des génériques ou l’augmentation du passage des génériques aux marques. Le TABLEAU 1 fournit une liste des obstacles possibles à la prescription et à la délivrance de médicaments génériques10-15

Une enquête menée auprès de patients épileptiques et de leurs préoccupations concernant les substitutions génériques a conclu que les patients croyaient que les changements ne devraient être déterminés que par le fournisseur ou le patient. Ces préoccupations découlaient des craintes des prestataires d’une percée de la crise lors d’un changement ou d’un risque accru d’effets secondaires et des préoccupations des patients que les génériques puissent ne pas fournir une efficacité ou une tolérance équivalente.16 Cependant, il est également démontré que le fait d’avoir une relation avec son pharmacien et de mettre le prestataire et les patients au courant des changements de fabricants peut aider à améliorer l’utilisation des génériques chez les patients épileptiques.17
En outre, certains cliniciens et scientifiques ont exprimé des préoccupations concernant l’approbation de la bioéquivalence par la FDA. Cependant, le Therapeutic Inequivalence Action Coordinating Committee, un groupe d’examen post-commercialisation de la FDA, identifie et évalue les rapports d’échecs thérapeutiques pour déterminer si le retrait des produits non équivalents est nécessaire.9 En outre, des études ont conclu que les tests de bioéquivalence requis par la FDA sont robustes et aident à soutenir l’approbation que les médicaments de marque et les génériques sont équivalents sur le plan thérapeutique.9
Des études ont examiné les taux de retour en arrière ou le nombre de fois où les patients reviennent aux médicaments de marque à partir des génériques malgré un différentiel de coût. Les études examinant les génériques autorisés et les génériques ont montré un taux plus faible de retour aux marques en raison des interventions visant à améliorer la communication et l’éducation sur l’équivalence des génériques et des produits de marque.11,12 En outre, les similitudes d’apparence ont également empêché les retours aux marques.11
En raison des récents rappels de produits génériques, les patients peuvent également appréhender de passer aux génériques car ils peuvent ne pas être produits aux États-Unis, croyant que les médicaments fabriqués en dehors des États-Unis ne sont pas sûrs, malgré l’approbation de la FDA. Une éducation appropriée sur les détails des rappels est efficace pour encourager l’adhésion aux médicaments.14
Malgré la disponibilité d’un médicament générique, l’utilisation d’un produit de marque peut être cliniquement appropriée dans certaines situations. Par exemple, les patients précédents prenant des médicaments épileptiques qui ont connu une augmentation de la fréquence des crises avec un changement de générique peuvent être appropriés pour un changement vers un médicament de marque pour le contrôle des crises.15
Avec les différents obstacles discutés ci-dessus, de multiples études ont montré que la promotion d’interventions éducatives pour les patients et les fournisseurs peut aider à augmenter la confiance dans l’utilisation des génériques.13 En outre, l’éducation sur l’utilisation des génériques peut aider à améliorer la qualité des soins et l’adhésion aux médicaments. Le rapport 2019 de l’AAM a analysé les taux d’abandon des médicaments, en examinant le taux auquel les patients peuvent ne pas prendre ou récupérer leurs médicaments malgré la demande de l’ordonnance. Le rapport conclut que les taux d’abandon des nouveaux patients sont 266 % plus élevés pour les médicaments de marque par rapport aux médicaments génériques.5 Les copayages ont joué un rôle important dans ce taux d’abandon ; 90 % des copayages des médicaments génériques étaient inférieurs à 20 $, contre 39 % pour les médicaments de marque.5
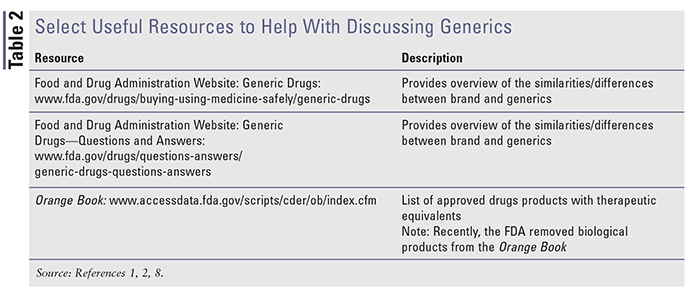
Ressources disponibles pour aider à l’éducation
De multiples ressources sont disponibles pour aider à comprendre et à discuter des médicaments de marque et des génériques. Veuillez consulter le TABLEAU 2 pour un aperçu de certaines ressources disponibles utiles.
CONCLUSION
En tant que pharmaciens, nous avons fait le serment d’appliquer nos connaissances pour assurer des résultats optimaux pour nos patients et préconiser des changements qui améliorent les soins aux patients. Améliorer l’observance, éduquer nos patients sur les faits et avoir une communication ouverte avec les fournisseurs sur l’information est essentiel pour que nous puissions remplir notre serment de pharmacien. La FDA suit un processus rigoureux pour approuver les médicaments génériques sur le marché américain. Cependant, en raison des perceptions ou de la quantité d’informations viables, les patients peuvent avoir une certaine appréhension à prendre des médicaments génériques. Des études ont prouvé que le fait de surmonter les obstacles et d’éduquer les patients et les fournisseurs sur les faits concernant les médicaments génériques par rapport aux médicaments de marque peut aider à améliorer la prescription de médicaments génériques et, en fin de compte, à produire des soins de santé abordables.
1. FDA. Médicaments génériques. www.fda.gov/drugs/buying-using-medicine-safely/generic-drugs. Consulté le 19 mars 2020.
2. FDA. Médicaments génériques : questions et réponses. www.fda.gov/drugs/questions-answers/generic-drugs-questions-answers. Consulté le 19 mars 2020.
3. Dunne S, Shannon B, Dunne C, Cullen W. Examen des différences et des similitudes entre les médicaments génériques et leurs homologues originaux, y compris les avantages économiques associés à l’utilisation de médicaments génériques, en utilisant l’Irlande comme étude de cas. BMC Pharmacol Toxicol. 2013;14:1.
4. IQVIA Institute for Human Data Science. Tendances mondiales en matière de dépenses et d’utilisation des médicaments : perspectives 2024. www.iqvia.com/-/media/iqvia/pdfs/institute-reports/global-medicine-spending-and-usage-trends.pdf?_=1586623006517. Consulté le 20 mars 2020.
5. Association pour l’accessibilité des médicaments. Les arguments en faveur de la concurrence : rapport 2019 sur l’accès aux médicaments génériques et aux biosimilaires et les économies réalisées aux États-Unis. https://accessiblemeds.org/sites/default/files/2019-09/AAM-2019-Generic-Biosimilars-Access-and-Savings-US-Report-WEB.pdf. Consulté le 20 mars 2020.
6. FDA. Approbations et bases de données de médicaments : ingrédient inactif. www.fda.gov/drugs/drug-approvals-and-databases/inactive-ingredient-search-approved-drug-products-frequently-asked-questions. Consulté le 20 mars 2020.
7. FDA. Demande abrégée de nouveau médicament (ANDA) : Liste de la FDA des médicaments génériques autorisés. www.fda.gov/drugs/abbreviated-new-drug-application-anda/fda-list-authorized-generic-drugs. Consulté le 21 mars 2020.
8. FDA : Orange Book : produits pharmaceutiques approuvés avec des évaluations d’équivalence thérapeutique. www.accessdata.fda.gov/scripts/cder/ob/index.cfm. Consulté le 21 mars 2020.
9. Davit BM, Nwakama PE, Buehler GJ, et al. Comparing generic and innovator drugs : a review of 12 years of bioequivalence data from the United States Food and Drug Administration. Ann Pharmacother. 2009;43(10):1583-1597.
10. Choudhry NK, Denberg D, Qaseem A. Improving adherence to therapy and clinical outcomes while containing costs : opportunities from the greater use of generic medications : best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2016;164:41-49.
11. Desai RJ, Sarpatwari A, Dejene S, et al. Diff
12. Hansen RA, Qian J, Berg R, et al. Comparaison des taux de passage du générique à la marque entre les médicaments génériques et les médicaments génériques autorisés. Pharmacothérapie. 2017;37(4):429-437.
13. Desai RJ, Sarpatwari A, Dejene S, et al. Efficacité comparative de l’utilisation des médicaments génériques et de marque : une étude de base de données des demandes de remboursement de l’assurance maladie américaine. PLoS Med. 2019;16(3):e1002763.
14. FDA. Ce qu’il faut savoir et faire au sujet des nitrosamines possibles dans vos médicaments. www.fda.gov/consumers/consumer-updates/what-know-and-do-about-possible-nitrosamines-your-medication. Consulté le 13 mai 2020.
15. Straka RJ, Keohane DJ, Liu LZ. Impact clinique et économique potentiel du passage des médicaments de marque aux génériques. Am J Ther. 2017;24(3):e278-e289.
16. Ngo SNT, Stupans I, McKinnon RA. La substitution générique dans le traitement de l’épilepsie : attitudes et perceptions des patients. Epilepsy Behav. 2013;26:64-66.
17. Greb E. Une étude révèle les préoccupations liées au passage des médicaments antiépileptiques de marque aux médicaments génériques. Neurology Rev. 2014;22(3):6.
Le contenu de cet article est uniquement destiné à des fins d’information. Le contenu n’est pas destiné à remplacer les conseils d’un professionnel. La confiance accordée à toute information fournie dans cet article est uniquement à vos risques et périls.
Il n’y a pas d’autre choix que d’utiliser les informations contenues dans cet article.