US Pharm. 2013;38(12):38-42.
ABSTRACT : Les inhibiteurs de la pompe à protons (IPP), disponibles avec ou sans ordonnance, sont couramment utilisés pour le traitement des troubles liés à l’acidité. Malgré leur facilité d’accès et leur utilisation courante, les IPP peuvent avoir des effets secondaires graves. Les conséquences à long terme de l’utilisation chronique des IPP comprennent un risque potentiellement accru d’hypocalcémie, d’hypomagnésémie, d’infections à Clostridium difficile et de pneumonie. Les pharmaciens communautaires sont prêts à fournir des recommandations fondées sur des données probantes et à éduquer les patients sur les avantages et les risques associés à l’utilisation chronique des IPP.
Les inhibiteurs de la pompe à protons (IPP) sont sur le marché depuis la fin des années 1980 et ont remplacé les antagonistes des récepteurs de l’histamine2 (H2RA) comme la classe de médicaments la plus puissante pour le traitement des maladies liées à l’acidité1. Les médicaments anti-ulcéreux (les domaines thérapeutiques sont basés sur les définitions exclusives d’IMS Health) représentaient la neuvième classe la plus importante en fonction du volume d’ordonnances aux États-Unis en 2012 et la onzième en termes de ventes.2,3
Les médicaments de la classe des IPP sont largement disponibles avec ou sans ordonnance. Actuellement, le marché américain contient six IPP, dont deux sont également disponibles en vente libre (TABLEAU 1).4-9 Au début des années 2000, la FDA a annoncé la disponibilité de l’oméprazole (Prilosec OTC) comme premier IPP en vente libre10. Il a rapidement été suivi par l’approbation du lansoprazole en vente libre (Prevacid 24HR).11
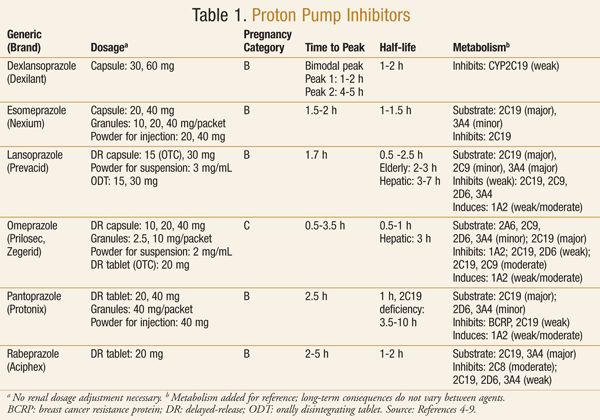
Les IPP sont utilisés pour le traitement de nombreuses affections gastriques, notamment l’ulcère gastroduodénal, l’éradication des infections à Helicobacter pylori, le traitement et la prévention de l’ulcère gastroduodénal dû aux anti-inflammatoires non stéroïdiens (AINS), le syndrome de Zollinger-Ellison et le reflux gastro-œsophagien (RGO).1 En général, ces médicaments sont prescrits en raison de leur faible incidence d’effets secondaires et de leur efficacité supérieure à celle d’autres médicaments utilisés pour traiter les mêmes affections1.
L’utilisation à long terme de tout médicament soulève des problèmes de sécurité, surtout si ce produit est disponible en vente libre. L’American Gastroenterological Association (AGA) a publié des lignes directrices sur la prise en charge du RGO en 2008 qui recommandaient de ne pas surveiller systématiquement les IPP en raison de preuves insuffisantes.12 Cependant, depuis lors, les études ont continué à montrer les conséquences à long terme de l’utilisation chronique des IPP, y compris les conséquences de la malabsorption et les infections. Par la suite, en mars 2013, l’American College of Gastroenterology (ACG) a publié des lignes directrices pour le diagnostic et le traitement du RGO.13 Ces lignes directrices donnent un aperçu de la surveillance des conséquences à long terme de l’utilisation chronique des IPP. Cet article est une revue de la littérature récente et des recommandations des lignes directrices concernant les conséquences possibles à long terme de la pharmacothérapie chronique par les IPP et les possibilités de prévenir ces complications.
Dans les études animales, les IPP ont soulevé des inquiétudes quant à un potentiel d’hypergastrinémie, mais les études humaines n’ont pas réussi à montrer une association1. Par conséquent, les conséquences à long terme de l’utilisation chronique des IPP peuvent être regroupées en deux catégories principales, la malabsorption et les infections.La malabsorption secondaire à l’utilisation des IPP affecte le calcium et le magnésium, et la littérature précise deux infections le plus souvent associées à l’utilisation des IPP, Clostridium difficile et la pneumonie. Malheureusement, il n’existe pas de définition du terme » long terme » dans la littérature ; ni les lignes directrices de l’AGA ni celles de l’ACG ne définissent ce qui est considéré comme long terme. Pour le reste de cet article, les auteurs utilisent le terme » long terme » pour désigner une thérapie supérieure à 14 jours, soit la thérapie maximale pour les produits en vente libre.10,11
Malabsorption
La première conséquence potentielle à long terme de l’utilisation chronique des IPP est la malabsorption de minéraux clés dans l’organisme, à savoir le calcium et le magnésium. La perte de ces minéraux pourrait entraîner des fractures osseuses ou des anomalies cardiaques.
Diminution de l’absorption du calcium (hypocalcémie) : L’utilisation à long terme des IPP a été associée à un risque accru d’ostéoporose et à une diminution de la densité minérale osseuse (DMO), avec un risque accru de 35 % de fractures.14 Le calcium joue un rôle important dans la santé et la formation des os, car il est un composant clé de l’hydroxyapatite (principal élément structurel de l’os). La matière osseuse est un réservoir important de calcium et peut contenir plus de 99 % du calcium de l’organisme.15 L’hypothèse du mécanisme des fractures osseuses induites par les IPP est que l’absorption du calcium alimentaire dépend d’un environnement acide dans le tractus gastro-intestinal (GI). En raison de la diminution de l’acidité due à l’effet pharmacologique des IPP, une perte potentielle de l’absorption du calcium se produit. Cette réduction de l’absorption du calcium entraîne une diminution de l’activité ostéoclastique et donc une diminution de la DMO, ce qui augmente le risque de fracture.1
Les lignes directrices 2013 de l’ACG sur le RGO indiquent qu’une ostéoporose existante n’est pas une contre-indication au traitement par IPP.13 Les patients atteints d’ostéoporose peuvent continuer à suivre un traitement par IPP, à moins qu’il n’existe un autre facteur de risque de fracture de hanche.13 Par ailleurs, en mars 2011, la FDA a modifié sa mise en garde contre l’ostéoporose et les fractures. Elle a conclu que les produits en vente libre ne justifient pas de modifier l’étiquette pour y inclure des avertissements sur le risque de fracture.16
Cependant, plusieurs études ont démontré une association entre l’utilisation à long terme des IPP et le risque de fractures, mais elles contiennent de nombreux facteurs de confusion. Les facteurs de risque communs de fractures, tels qu’un mode de vie sédentaire et l’utilisation concomitante de certains médicaments (par exemple, les diurétiques thiazidiques, l’hormonothérapie substitutive, les corticostéroïdes), sont souvent observés chez les patients qui prennent régulièrement des IPP.14 De plus, les patients qui prennent des doses élevées d’IPP présentent un risque de fracture plus élevé que ceux qui prennent des doses plus faibles en vente libre17. Enfin, les patients qui prennent des IPP pendant des périodes prolongées (>1 an) sont plus susceptibles de subir une fracture.18
Une analyse des données obtenues dans le cadre de l’étude canadienne multicentrique sur l’ostéoporose a révélé que l’utilisation des IPP était associée à une DMO plus faible, en particulier au niveau de la hanche et du col du fémur, par rapport à l’utilisation de médicaments sans IPP.19 Cependant, l’utilisation à long terme des IPP n’était pas associée à un déclin accéléré de la DMO. Targownik et al ont rapporté que les patients utilisant des IPP avaient effectivement une DMO plus faible ; cependant, ces patients étaient significativement plus âgés (66,3 vs 60,9 ans ; P <.001) et avaient un indice de masse corporelle (IMC) moyen plus élevé (28.3 contre 26,9 ; P <.001).19
Les données restent relativement peu concluantes et contradictoires concernant l’ampleur de l’association IPP et fracture en l’absence de facteurs de risque supplémentaires. Selon les lignes directrices de l’ACG de 2013, les données probantes sont insuffisantes pour justifier des tests de DMO de routine, la prise de suppléments de calcium ou d’autres précautions de routine en raison de l’utilisation d’IPP13. En revanche, Santé Canada a émis une alerte en avril 2013 indiquant que les patients présentant des facteurs de risque existants d’ostéoporose devraient être surveillés de près et devraient également recevoir un traitement de courte durée par IPP à la dose efficace la plus faible20. Ceci est parallèle aux recommandations actuelles de la FDA malgré l’absence de recommandations de l’ACG.16 Si une supplémentation en calcium est indiquée, l’utilisation de citrate de calcium est le supplément de calcium préféré chez les patients prenant des IPP, car il peut être absorbé en l’absence d’un environnement acide.1
Diminution de l’absorption du magnésium (hypomagnésémie) : En mars 2011, la FDA a publié une mise en garde concernant les faibles taux de magnésium sérique associés à l’utilisation à long terme des IPP.21 Une analyse des rapports du système de déclaration des événements indésirables (AERS) de la FDA indique qu’environ 1 % des patients qui ont subi un effet indésirable alors qu’ils prenaient un IPP ont présenté une hypomagnésémie.21 Le mécanisme à l’origine des modifications de l’absorption est inconnu. Les symptômes de l’hypomagnésémie comprennent les convulsions, l’arythmie, l’hypotension et la tétanie. L’hypomagnésémie est également potentiellement mortelle.22 L’hypomagnésémie liée à l’utilisation chronique des IPP n’a pas été abordée dans les lignes directrices de l’ACG de 2013.13
Tous les IPP sont associés à une diminution de l’absorption du magnésium.21 L’hypomagnésémie était plus fréquente chez les patients plus âgés prenant un IPP (âge moyen de 64,4 ans).21 Le délai moyen d’apparition de l’hypomagnésémie était de 5,5 ans après le début du traitement.21 De même, une revue systématique des rapports de cas a révélé que les patients qui présentaient une hypomagnésémie associée à l’utilisation d’un IPP présentaient également d’autres perturbations électrolytiques, en particulier une hypokaliémie et une hypocalcémie.23 L’hypomagnésémie disparaissait généralement avec l’arrêt de l’IPP et réapparaissait peu après la reprise du traitement par l’IPP.24
L’utilisation concomitante de médicaments qui diminuent également le magnésium augmente le risque d’hypomagnésémie importante. Danziger et al ont rapporté que les patients qui prennent un IPP avec un diurétique ont un risque d’hypomagnésémie près de 55 % plus élevé que les patients qui ne prennent qu’un IPP.22
Une communication sur la sécurité des médicaments de la FDA met en garde contre les risques d’hypomagnésémie et recommande aux prestataires de surveiller les taux de magnésium sérique chez les patients qui prennent des IPP21. La FDA suggère aux prestataires d’obtenir les taux de magnésium sérique avant l’initiation du traitement et périodiquement par la suite pour les patients qui poursuivront un traitement prolongé et pour les patients qui prennent des médicaments qui provoquent également une hypo-magnésémie. Les patients qui présentent une hypomagnésémie cliniquement significative peuvent nécessiter l’arrêt du traitement par IPP, le remplacement du magnésium par des méthodes orales ou IV et un traitement par une autre classe de médicaments pour les affections gastro-intestinales, comme un ARH2.1
Infections
En plus d’une diminution de l’absorption du magnésium et du calcium, les patients sous IPP à long terme peuvent présenter un risque accru d’infection. L’hypothèse du mécanisme d’action est que les sécrétions d’acide gastrique agissent comme un mécanisme de défense contre les bactéries entériques, et que l’augmentation du pH gastrique pendant la prise d’IPP permet la colonisation de microbes opportunistes1. Les lignes directrices de l’ACG de 2013 ont mis en garde contre le risque d’augmentation des infections de C difficile et de pneumonie communautaire (PAC).13
Clostridium difficile : dans une étude rétrospective de 2005, les chercheurs ont constaté que les patients qui prenaient des IPP avaient un rapport de risque (RR) de 2,9 (IC à 95 %, 2,4-3,4) ; c’est-à-dire que, Le risque de contracter le C difficile était 2,9 fois plus élevé chez les patients qui prenaient des IPP que chez ceux qui n’en prenaient pas.25 Soixante-quinze pour cent des patients chez qui des cas ont été signalés étaient âgés de plus de 65 ans. Non seulement l’utilisation à long terme des IPP entraîne une augmentation de l’incidence du C difficile, mais les patients qui ont reçu un IPP pendant le traitement du C difficile étaient également 42 % (IC à 95 %, 1,11-1,82) plus susceptibles d’avoir une infection récurrente après la fin du traitement25.
Une étude réalisée en 2010 par Linsky et al s’est penchée sur l’association entre l’utilisation des IPP et la récurrence du C difficile.26 Les auteurs ont déterminé si le patient avait ou non une infection à C difficile récurrente, 15 à 90 jours après l’infection initiale à C difficile, si le patient avait reçu un IPP dans les 14 jours suivant l’infection initiale à C difficile. Le HR pour les patients exposés aux IPP pendant le traitement était de 1,42 (IC 95 %, 1,11-1,82). Pour les patients âgés de plus de 80 ans, le HR passe de 1,42 à 1,86 (IC à 95 %, 1,15-3,01).26
En 2012, la FDA a publié une déclaration détaillant la relation entre la diarrhée associée au C difficile (DACD) et l’utilisation d’un IPP.27 L’alerte de sécurité de la FDA avertit les patients et les professionnels de santé d’envisager une DACD si un patient prend un IPP et présente une diarrhée persistante27. La FDA recommande également que les patients reçoivent la dose la plus faible pendant la période la plus courte possible pour traiter leur état actuel.27 Les lignes directrices 2013 de l’ACG recommandent d’utiliser les IPP avec prudence chez les patients présentant un risque d’infections à C difficile.13
Pneumonie acquise dans la communauté : Les patients prenant des IPP peuvent potentiellement être exposés à un risque accru de PAC. Cependant, le degré d’association n’est pas clair en raison de données contradictoires.28-30 Les lignes directrices 2013 de l’ACG indiquent que l’utilisation des IPP à court terme peut augmenter le risque de PAC, mais le risque ne semble pas être élevé en cas d’utilisation à long terme.13
Une étude de cohorte réalisée en 2012 par de Jagar et al a montré que les patients sous IPP étaient 2,23 fois (IC à 95 %, 1,28-3,75) plus susceptibles de développer une infection à PAC que les patients ne prenant pas d’IPP31. Dans une méta-analyse réalisée en 2004, les chercheurs ont découvert que les patients qui prenaient un agent antiacide, soit un IPP ou un ARH2, étaient 4,5 fois (IC à 95 %, 3,8-5,1) plus susceptibles de développer une pneumonie30. La durée moyenne d’utilisation des ARH2 était de 2,8 mois ; pour les IPP, la durée moyenne était de 5 mois30.
A l’inverse, une étude menée en 2008 par Sarkar et al a montré que l’utilisation actuelle des IPP n’était pas associée à un risque accru de PAC (odds ratio 1,02, IC 95 % 0,97-1,08).29 Cependant, l’étude a observé un risque accru de contracter une infection chez les patients initiés sous IPP au cours des 14 derniers jours (OR ajusté 3,21, IC 95 % 2,46-4,18).29
Les données soutiennent une augmentation à court terme du risque d’infections par pneumonie, mais elles sont contradictoires concernant les conséquences à long terme. Malgré les données contradictoires, il est important de tenir compte de ce risque, notamment en raison des nouvelles réglementations des Centers for Medicare & Medicaid (CMS) sur les réadmissions à l’hôpital.32 Laheij et al ont déterminé que le taux d’incidence de la pneumonie était de 2,5 pour 100 années-patients chez les patients sous IPP30. Avec 65,7 millions d’ordonnances pour le seul oméprazole et un coût accru de 15 682 $ pour les bénéficiaires de Medicare en raison des hospitalisations pour pneumonie, le risque d’infections associées à l’utilisation des IPP justifie la vigilance et la médecine factuelle de la part du pharmacien.33,34
Conclusion
Les IPP constituent une classe de médicaments efficace et sûre. Ils offrent un soulagement aux patients dans un système de soins de santé centré sur le patient. Malheureusement, ces agents ont potentiellement certaines conséquences à long terme d’une utilisation continue, notamment des problèmes de malabsorption et un risque accru d’infections. Le pharmacien peut être un défenseur du patient dans le système hospitalier ou dans la communauté en comprenant ces risques et en favorisant des soins centrés sur le patient en habilitant un patient bien informé dans les décisions de soins de santé.
1. Wolfe M. Aperçu et comparaison des inhibiteurs de la pompe à protons pour le traitement des troubles liés à l’acidité. Dans : Basow DW, ed. UpToDate. Waltham, MA : UpToDate ; 2013.
2. Principales classes thérapeutiques par ordonnances dispensées (États-Unis). IMS Health. Mis à jour le 22 mars 2013. www.imshealth.com/deployedfiles/imshealth/Global/Content/Corporate/Press%20Room/2012_U.S/Top_Therapeutic_Classes_Dispensed_Prescriptions_2012.pdf. Consulté le 4 novembre 2013.
3. Principales classes thérapeutiques par dépenses non actualisées (US). IMS Health. Mis à jour le 17 février 2013. www.imshealth.com/deployedfiles/imshealth/Global/Content/Corporate/Press%20Room/2012_U.S/Top_Therapeutic_Classes_by_Non-Discounted_Spending.U.S.pdf. Consulté le 4 novembre 2013.
4. Dexlansoprazole. Lexi-Comp Online. Hudson, OH : Lexi-Comp, Inc. http://online.lexi.com. Consulté le 15 août 2013.
5. Esoméprazole. Lexi-Comp Online. Hudson, OH : Lexi-Comp, Inc. http://online.lexi.com. Consulté le 15 août 2013.
6. Lansoprazole. Lexi-Comp Online. Hudson, OH : Lexi-Comp, Inc. http://online.lexi.com. Consulté le 15 août 2013.
7. oméprazole. Lexi-Comp Online. Hudson, OH : Lexi-Comp, Inc. http://online.lexi.com. Consulté le 15 août 2013.
8. Pantoprazole. Lexi-Comp Online. Hudson, OH : Lexi-Comp, Inc. http://online.lexi.com. Consulté le 15 août 2013.
9. Rabeprazole. Lexi-Comp Online. Hudson, OH : Lexi-Comp, Inc. http://online.lexi.com. Consulté le 15 août 2013.
10. Renseignements sur Prilosec OTC (oméprazole). FDA. 21 septembre 2010. www.fda.gov/AboutFDA/CentersOffices/OfficeofMedicalProductsandTobacco/CDER/ucm220944.htm. Consulté le 5 juin 2013.
11. Novartis lance Prevacid 24HR en vente libre pour un véritable soulagement des brûlures d’estomac fréquentes pendant 24 heures. Communiqués de presse de Novartis. 12 novembre 2009. https://www.prevacid24hr.com/news-press-releases.html. Consulté le 5 juin 2013.
12. Kahrilas PJ, Shaheen NJ, Vaezi MF, et al. Examen technique de l’Institut de l’American Gastroenterological Association sur la prise en charge du reflux gastro-œsophagien. Gastroenterology. 2008;135:1392-1413.
13. Katz P, Gerson L, Vela, M. Lignes directrices pour le diagnostic et la prise en charge du reflux gastro-œsophagien. Am J Gastroenterol. 2013;108:308-328.
14. Khalili H, Huang ES, Jacobson BC, et al. Utilisation d’inhibiteurs de la pompe à protons et risque de fracture de la hanche en relation avec les facteurs alimentaires et le mode de vie : une étude de cohorte prospective. BMJ. 2012;344:e372.
15. Flynn A. Le rôle du calcium alimentaire dans la santé osseuse. Proc Nutr Soc. 2003;62:851-858.
16. Communication sur la sécurité des médicaments de la FDA : Augmentation possible du risque de fractures de la hanche, du poignet et de la colonne vertébrale avec l’utilisation d’inhibiteurs de la pompe à protons. FDA. 28 mars 2011. www.fda.gov/drugs/drugsafety/postmarketdrugsafetyinformationforpatientsandproviders/ucm213206.htm. Consulté le 11 juin 2013.
17. Yang YX, Lewis JD, Epstein S, Metz DC. Traitement par inhibiteur de la pompe à protons à long terme et risque de fracture de la hanche. JAMA. 2006;296:2947-2953.
18. Targownik LE, Lix LM, Metge CJ, et al. Use of proton pump inhibitors and risk of osteoporosis-related fractures. JAMC. 2008;179:319-326.
19. Targownik LE, Leslie WE, Davison KS, et al. The relationship between proton pump inhibitor use and longitudinal change in bone mineral density : a population-based study from the Canadian Multicentre Osteoporosis Study (CaMos). Am J Gastroenterol. 2012;107:1361-1369.
20. Inhibiteurs de la pompe à protons : risque de fractures osseuses. Santé Canada. 4 avril 2013. http://healthycanadians.gc.ca/recall-alert-rappel-avis/hc-sc/2013/26523a-eng.php. Consulté le 27 août 2013.
21. Communication sur la sécurité des médicaments de la FDA : De faibles niveaux de magnésium peuvent être associés à l’utilisation à long terme de médicaments inhibiteurs de la pompe à protons (IPP). FDA. 14 mars 2011. www.fda.gov/drugs/drugsafety/ucm245011.htm. Consulté le 11 juin 2013.
22. Danziger J, William JH, Scott DJ, et al. L’utilisation d’inhibiteurs de la pompe à protons est associée à de faibles concentrations de magnésium sérique. Kidney Int. 2013;83:692-699.
23. Luk CP, Parsons R, Lee YP, Hughes JD. Hypomagnésémie associée aux inhibiteurs de la pompe à protons : que nous disent les données de la FDA ? Ann Pharmacother. 2013;47:773-780.
24. Hess MW, Hoenderop JG, Bindels RJ, Drenth JP. Revue systématique : hypomagnésémie induite par l’inhibition de la pompe à protons. Aliment Pharmacol Ther. 2012;36:405-413.
25. Dial S, Delaney JA, Barkun AN, Suissa S. Utilisation d’agents de suppression de l’acide gastrique et risque de maladie communautaire associée à Clostridium difficile. JAMA. 2005;294:2989-2995.
26. Linsky A, Gupta K, Lawler EV, et al. Inhibiteurs de la pompe à protons et risque d’infection récurrente à Clostridium difficile. Arch Intern Med. 2010;170:772-778.
27. Inhibiteurs de la pompe à protons (IPP) – communication sur la sécurité des médicaments : La diarrhée associée à Clostridium difficile (DACD) peut être associée aux médicaments contre l’acidité gastrique. FDA. www.fda.gov/safety/medwatch/safetyinformation/safetyalertsforhumanmedicalproducts/ucm290838.htm. Consulté le 5 juin 2013.
28. Gulmez SE, Holm A, Frederiksen H, et al. Utilisation d’inhibiteurs de la pompe à protons et le risque de pneumonie acquise dans la communauté : une étude cas-témoin basée sur la population. Arch Intern Med. 2007;167:950-955.
29. Sarkar M, Hennessy S, Yang YX. Utilisation d’inhibiteurs de la pompe à protons et risque de pneumonie acquise dans la communauté. Ann Intern Med. 2008;149:391-398.
30. Laheij RJ, Sturkenboom MC, Hassing RJ, et al. Risque de pneumonie acquise en communauté et utilisation de médicaments suppresseurs d’acide gastrique. JAMA. 2004;292:1955-1960.
31. de Jager CP, Wever PC, Gemen EF, et al. Proton pump inhibitor therapy predisposes to community-acquired Streptococcus pneumoniae pneumonia. Aliment Pharmacol Ther. 2012;36:941-949.
32. Rau J. Medicare va pénaliser 2 217 hôpitaux pour des réadmissions excessives. Kaiser Health News. 13 août 2012. www.kaiserhealthnews.org/Stories/2012/August/13/medicare-hospitals-readmissions-penalties.aspx. Consulté le 1er septembre 2012.
33. Les 25 premiers médicaments par ordonnances délivrées (États-Unis). IMS Health. Mis à jour le 22 mars 2013. www.imshealth.com/deployedfiles/imshealth/Global/Content/Corporate/Press%20Room/2012_U.S/Top_25_Medicines_Dispensed_Prescriptions_U.S.pdf. Consulté le 4 novembre 2013.
34. Thomas CP, Ryan M, Chapman JD, et al. Incidence et coût de la pneumonie chez les bénéficiaires de Medicare. Chest. 2012;142:973-981.
Pour commenter cet article, contactez [email protected].
.