Les charges formelles en chimie organique sont, peut-être, l’un des dispositifs comptables les plus fondamentaux qui est souvent mal compris ou négligé par les étudiants.
Pourquoi les charges formelles sont importantes en chimie organique?
Connaître les charges formelles peut nous aider à comprendre les schémas de réactivité dans les réactions, à trouver les centres réactifs et à donner un sens au flux d’électrons dans les mécanismes. Par exemple, les espèces chargées négativement ont tendance à être les sources de densité électronique dans les réactions, tandis que les espèces chargées positivement-acceptent ces électrons.
Voici quelques exemples de molécules avec des charges formelles:
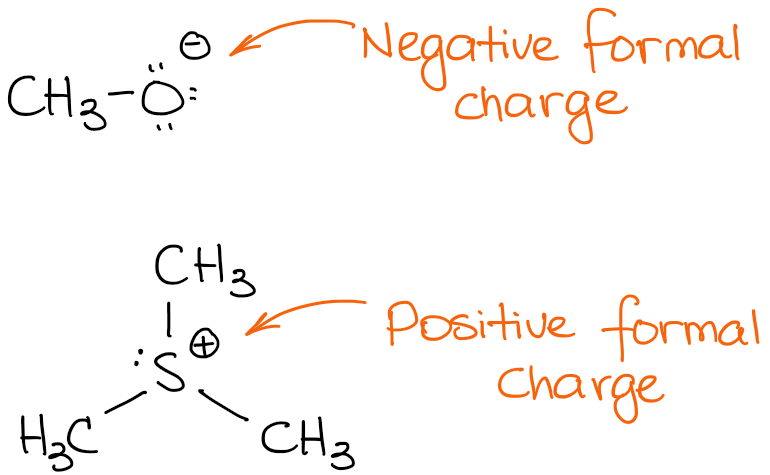
L’espèce du haut a une charge négative. On appelle de telles espèces des anions. Comme elle a une charge négative, cela signifie qu’elle a un excès de densité électronique. Ainsi, elle est susceptible d’être la source de ces électrons dans une réaction. Les sources de densité électronique dans une réaction organique agissent comme des nucléophiles ou des bases.
La deuxième espèce porte une charge positive, c’est donc une espèce cationique. Dans une réaction, une espèce cationique sera un accepteur d’électrons agissant comme un acide (de Brønsted ou de Lewis) ou comme un électrophile.
Il est important de garder à l’esprit qu’une charge formelle n’est pas la même chose qu’une charge réelle ! J’en parlerai un peu plus loin dans ce billet.
Comment calculer une charge formelle
La façon » officielle » est de soustraire 1/2 électrons de liaison et électrons non liants des électrons de valence possibles qu’un atome peut avoir. En d’autres termes :

Qu’est-ce que tous ces termes ?
Les électrons de liaison sont ceux qui constituent les liaisons. Chaque liaison contient 2 électrons. Ainsi, 1/2 des électrons de liaison est égal au nombre de liaisons et l’atome possède.
Les électrons non liants sont ceux qui ne participent à aucune liaison. En d’autres termes, les électrons non liants sont les électrons de réserve (généralement des paires d’électrons) sur un atome. En utilisant les exemples ci-dessus, nous avons:

Les définitions et la méthode « officielle » semblent un peu moches. En tant que chimiste professionnel, je peux parler toute la journée des « règles officielles » et des « noms propres » et vous ennuyer à mourir. Au lieu de cela, je préfère que vous utilisiez une simple « astuce » qui fonctionne toujours et qui, essentiellement, revient au même. L’astuce est la suivante :
Charge formelle = électrons de valence – bâtons – points
Le nombre d’électrons de valence est égal au groupe (colonne) de l’élément dans le tableau périodique. Ainsi, le carbone en a 4, l’oxygène en a 6 et l’hydrogène a 1 électron de valence. Les liaisons et les électrons de réserve sont indiqués (ou peuvent être facilement trouvés) dans la structure de Lewis de la molécule. Ainsi, tant que vous avez une structure de Lewis complète et un tableau périodique à portée de main, vous pouvez trouver rapidement la charge formelle de n’importe quel atome dans une molécule.
La différence entre la charge formelle et la charge réelle
Maintenant, j’ai mentionné précédemment qu’il y a une différence entre la charge formelle et la charge réelle. La charge formelle est un outil de comptabilité qui est important pour nous aider à garder une trace du flux d’électrons dans la réaction.
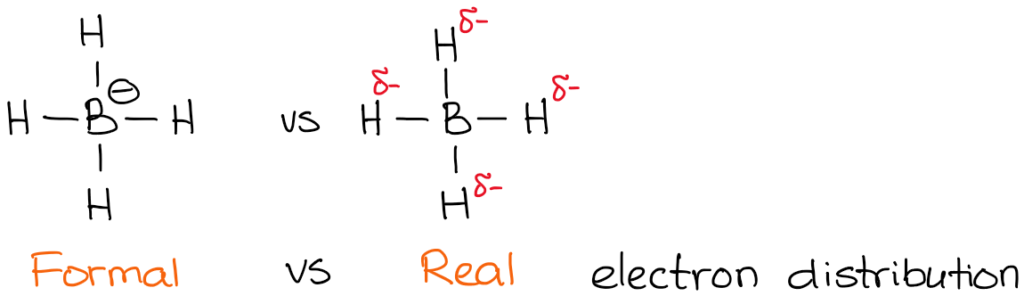
La charge réelle, cependant, est la densité réelle d’électrons qui est présente sur l’atome. Par exemple, jetons un coup d’œil à l’anion borohydrure :

L’électronégativité du bore est de 2.0 alors que l’électronégativité de l’hydrogène est de 2,2. Donc, l’hydrogène est plus électronégatif (pas de beaucoup mais quand même) et va polariser la liaison. Cela signifie que l’hydrogène « tire » la densité électronique vers lui. Ainsi :
Bien que les charges formelles soient simplement une « formalité, », elles sont très importantes pour la compréhension des mécanismes de réactions. Ainsi, vous devez vous assurer que vous maîtrisez la compétence de trouver rapidement la charge formelle.
Vous avez également remarqué que j’ai indiqué mes densités électroniques réelles avec le symbole delta-minus (𝛿-). Cela indique que je n’ai qu’une charge négative partielle sur chacun des hydrogènes. Quelle quantité de cette charge partielle avons-nous sur eux ? On pourrait la calculer en utilisant des calculs de chimie quantique sophistiqués, mais ce n’est absolument pas nécessaire dans le cadre d’un cours typique de chimie organique. Ce qui est plus important, c’est de réaliser que le bore n’est pas réellement chargé négativement dans cette molécule. Ainsi, lorsque nous écrivons une réaction avec un anion borohydrure, nous ne montrerons pas d’électrons provenant du bore !
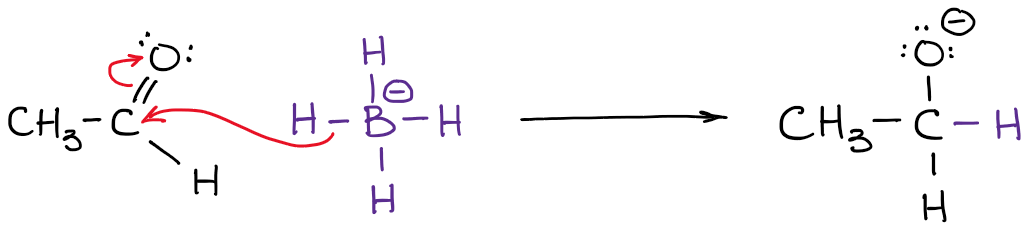
.