Vous avez peut-être entendu parler du composé chimique qui manque de liaisons C-H. Ces composés sont connus sous le nom de « composés inorganiques » car ils ne sont pas les composés organiques en raison de l’absence de carbone. Le trifluorure de bore est le composé inorganique, et sa formule est BF3. Il ne contient pas de couleur, et c’est un gaz toxique. Il crée des fumées blanches dans l’air humide. S’il se présente sous la forme d’un liquide incolore, il est très soluble (dihydrate.)
Contenu
Géométrie moléculaire du BF3
La géométrie de la molécule de BF3 est ‘Planaire trigone’. Avec la référence de la chimie, ‘Trigonal Planar’ est un modèle avec trois atomes autour d’un atome au milieu. C’est comme des atomes périphériques tous dans un même plan, car tous les trois sont similaires avec les angles de liaison de 120° sur chacun qui en font un triangle équilatéral.
Structure de Lewis du BF3

Pour connaître la structure de Lewis du BF3, nous devons calculer le nombre total d’électrons de valence de la molécule de BF3. Le BF3 possède un total de 24 électrons de valence, que nous devons placer autour de l’atome central. Avant de compléter les octets, n’oubliez pas de déterminer combien d’électrons de valence il y a dans le trifluorure de bore et de les placer en conséquence.
Le bore sera au centre de la structure car il est le moins électronégatif. Il a besoin de six électrons de valence dans sa coquille extérieure. Si nous vérifions les charges formelles de la structure de Lewis du trifluorure de bore, nous constaterons qu’elles sont nulles même si le bore n’avait que six électrons de valence.
Comment dessiner la structure de Lewis de BF3 ?
Pour dessiner une structure de Lewis, il faut tout d’abord ajouter des électrons et dessiner les connectivités. Comme nous l’avons vu, il y a ici 24 électrons. Ensuite, ajoutez des octets à l’atome extérieur et des électrons supplémentaires à l’atome central. Mais, comme nous le savons, il n’y a pas d’électrons supplémentaires. (24 – 24 = 0)
Violations
Une chose à garder à l’esprit en dessinant la structure de Lewis est que la règle des octets peut être violée dans ces trois situations ; mais, nous n’avons pas besoin d’y penser à chaque fois car c’est rare et ces exceptions ne se produiront qu’en cas de nécessité.
Exception 1 : S’il y a un nombre impair d’électrons de valence comme 3,5,7, etc.
Exception 2 : S’il y a très peu d’électrons de valence
Exception 3 : S’il y a trop d’électrons de valence
Ici, dans ce cas, l’électron central n’a pas d’octet car il a six particules. Donc, essayez d’ajouter plus d’une liaison pour décider si l’atome central peut atteindre un octuor ou non !
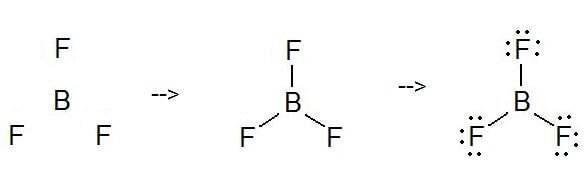
Comme vous pouvez le voir, il a maintenant un octuor.
Hybridation BF3
L’hybridation consiste à mélanger les orbitales atomiques en de nouvelles orbitales hybrides. Elles sont accommodantes pour expliquer la géométrie moléculaire et les propriétés de liaison nucléaire. Il existe plusieurs types d’hybridation comme SP3, SP2, SP. BF3 est une hybridation SP2. Pour cette molécule, il s’agit d’une hybridation SP2 car une liaison π (pi) est nécessaire pour la double liaison entre les atomes de bore et seulement trois liaisons σ sont formées par atome de bore. Les orbitales atomiques S – et P – de l’enveloppe externe du Bore se mélangent pour former trois orbitales hybrides SP2 équivalentes.
Polarité du BF3
La polarité désigne une séparation de la charge électrique conduisant à une molécule ou à ses groupes ayant un moment dipolaire ou multipolaire électrique. Si on parle de contradiction, alors la réponse est NON ! BF3 est non polaire. Lorsque la différence d’électronégativité entre les deux atomes est inférieure à 0,5, il est majoritairement non polaire.

J’espère que cet article a eu du sens pour vous et vous a aidé à comprendre la structure de Lewis, la géométrie moléculaire, l’hybridation et la polarité de BF3. Restez à l’écoute pour en savoir plus sur de différentes formules et d’autres trucs importants concernant votre chimie bien-aimée.