CONCEPT DU DÉFAUT ANIONIQUE – SA DÉFINITION ET SON CALCUL
Le plasma sanguin est une solution aqueuse (eau) contenant une pléthore d’espèces chimiques dont certaines ont une charge électrique nette, résultat de la dissociation des sels et des acides dans le milieu aqueux. Ceux qui ont une charge positive nette sont appelés cations et ceux qui ont une charge négative nette sont appelés anions ; collectivement, ces espèces chargées électriquement sont appelées ions.
La loi de neutralité électrochimique exige que, comme toutes les solutions, le sérum/plasma sanguin soit électrochimiquement neutre de sorte que la somme de la concentration des cations soit toujours égale à la somme de la concentration des anions .
Cette loi immuable est reflétée dans la FIGURE 1, une représentation graphique de la concentration des principaux ions normalement présents dans le plasma/sérum. Il en ressort clairement que, quantitativement, le cation le plus important du plasma est le sodium (Na+), et que les anions les plus importants sont le chlorure (Cl-) et le bicarbonate HCO3-.
La concentration de ces trois constituants plasmatiques (sodium, chlorure et bicarbonate) ainsi que du cation potassium (K+) est systématiquement mesurée au laboratoire clinique dans le cadre du profil biochimique le plus fréquemment demandé, urée et électrolytes (U&E).
FIGURE 1 : Anatomie ionique normale du sérum
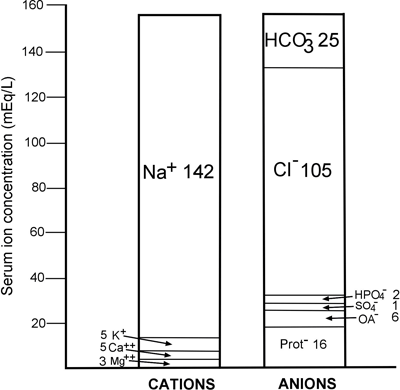
Il ressort clairement de la FIGURE 1 que la concentration du cation principal, le sodium (142 mmol/L), dépasse de 12 mmol/L les concentrations combinées des deux anions principaux, le chlorure et le bicarbonate (130 mmol/L).
C’est ce qu’on appelle le déficit anionique, qui est défini comme la différence entre la concentration de sodium dans le plasma/sérum et la somme des concentrations de chlorure et de bicarbonate dans le plasma/sérum :
| Espace anionique (AG) (mmol/L) = -. ( + ) Définition 1 | |
| Où | = la concentration plasmatique/sérique en sodium (mmol/L) |
| = la concentration plasmatique/sérique en chlorure. (mmol/L) | |
| = la concentration en bicarbonate du plasma/sérum (mmol/L) | |
Une alternative, moins fréquemment utilisée, permet d’inclure le cation potassium (K+) dans la définition du trou anionique :
Espace anionique (AG) (mmol/L) = ( + ) – ( + ) Définition 2
Donc pour un individu présentant les valeurs d’électrolytes plasmatiques suivantes :
| Sodium plasmatique | 139 mmol/L | Potassium plasmatique | 4.0 mmol/L | Chlorure plasmatique | 103 mmol/L | Bicarbonate plasmatique | 26 mmol/L |
| Le trou anionique est | soit 139 – (103 + 26) = 10 mmol/L si l’on utilise la définition 1 |
| OU (139 + 4.0) – (103+26) =14 mmol/L si la définition 2 est utilisée. |
Malheureusement, il n’existe toujours pas de consensus sur celle des deux définitions qui est adoptée, mais pour une interprétation précise des résultats des patients, il est évidemment important de savoir laquelle des deux définitions a été utilisée. Dans la suite de cet article, la définition 1 sera utilisée.
Le gap anionique calculé est une construction artificielle qui reflète simplement le fait que la concentration des cations communément mesurés dépasse la concentration des anions communément mesurés.
La loi de neutralité électrochimique exige que, globalement, l’écart anionique du sérum, après avoir pris en compte la concentration combinée de tous les cations non mesurés et de tous les anions non mesurés , soit égal à zéro :
Espace anionique (AG) = ( + ) – ( + + ) = 0
Il en résulte que l’espace anionique « calculé » reflète une inégalité entre la concentration combinée des anions non mesurés et la concentration combinée des cations non mesurés , et souligne le fait important que l’écart anionique calculé est autant fonction de la concentration d’ions non mesurés que de la concentration des ions mesurés (Na, Cl, HCO3) utilisés pour effectuer le calcul. A partir de l’équation ci-dessus, nous pouvons affirmer que :
+ = + + et par réarrangement
– ( + ) = –
et puisque l’écart anionique (AG) = – ( + ) alors
l’écart anionique (AG) = –
Donc l’écart anionique peut aussi être défini comme la différence entre les cations non mesurés et les anions non mesurés .
ECARTEMENT ANIONIQUE – INTERVALLE DE RÉFÉRENCE
Il existe une incohérence dans la littérature concernant l’intervalle de référence de l’écart anionique . Traditionnellement, l’intervalle de référence était largement accepté comme étant de 8-16 mmol/L si le potassium est exclu (définition 1) .
Cela se rapproche de 12-20 mmol/L si le potassium est inclus dans le calcul de l’AG. Les résultats de plusieurs études suggèrent un intervalle de référence beaucoup plus faible de 3-10 mmol/L. Cette modification de l’intervalle de référence est généralement attribuée à un changement dans la méthodologie utilisée pour mesurer le sodium et le chlorure . La photométrie de flamme était autrefois la seule méthode de mesure du sodium, et le chlorure était mesuré par colorimétrie.
Cependant, depuis 1990, ces techniques ont été largement abandonnées au profit de la mesure par électrode sélective d’ions. Cela ne peut pas être la totalité de l’explication car il reste une différence significative dans le gap anionique calculé entre les analyseurs modernes qui utilisent tous des électrodes sélectives d’ions.
Par exemple, Roberts et al ont comparé l’écart anionique déterminé à l’aide de trois analyseurs différents (utilisant tous une électrode sélective d’ions) et ont conclu que l’intervalle de référence traditionnel plus élevé de 8-16 mmol/L était proche d’être approprié pour deux analyseurs, mais inapproprié pour le troisième.
Pour cet analyseur, l’intervalle inférieur de 3-10 mmol/L était beaucoup plus approprié.
Paulson et al ont également montré que l’AG diffère selon le système de mesure. Ils ont calculé l’AG moyen de sujets sains pour huit analyseurs (utilisant tous une électrode sélective d’ions).
Les huit moyennes variaient de 5,9 mmol/L à 12 mmol/L. Ainsi, l’intervalle de référence de 8-16 mmol/L s’est avéré tout à fait approprié pour certains analyseurs, mais beaucoup trop élevé pour d’autres.
Il est évident que chaque laboratoire doit déterminer son propre intervalle de référence, et les médecins ne peuvent pas supposer que l’intervalle de référence traditionnel de 8-16 mmol/L, qui est encore largement cité dans les textes médicaux, est nécessairement approprié pour l’interprétation des résultats des patients dans leur établissement.
DÉVIATION DE L’ÉCART ANIONIQUE
L’écart anionique anormal est un phénomène relativement fréquent chez les patients hospitalisés, l’écart anionique augmenté étant beaucoup plus fréquent que l’écart anionique réduit.
Une étude rétrospective de 6868 ensembles d’électrolytes sériques chez des patients hospitalisés , par exemple, a révélé des incidences d’écart anionique augmenté et réduit de 37,6 % et 2,9 %, respectivement.
Puisque le calcul précis du trou anionique nécessite une mesure précise des électrolytes, des erreurs de laboratoire aléatoires peuvent donner lieu à un trou anionique réduit et augmenté. Il convient de prendre dûment en considération cette possibilité, si une cause pathologique de la déviation du trou anionique n’est pas évidente.
Causes pathologiques de la réduction du trou anionique
Il sera évident, d’après la discussion précédente, que la réduction du trou anionique surviendra théoriquement s’il y a soit une augmentation des cations non mesurés, soit une diminution des anions non mesurés.
Au pH physiologique, la somme des charges négatives des protéines normalement présentes dans le sérum dépasse de loin la somme des charges positives, de sorte que les protéines sériques contribuent de manière significative à la totalité des anions non mesurés et de manière insignifiante à la totalité des cations non mesurés.
En fait, 80 % du déficit anionique est dû aux protéines sériques (voir FIGURE 1). L’albumine étant la plus abondante des protéines à prédominance anionique du sérum, il n’est pas surprenant que la réduction de l’albumine sérique (hypoalbuminémie) réduise le trou anionique.
Feldman et al ont déterminé que pour chaque réduction de 10 g/L d’albumine sérique, le trou anionique sérique est réduit de 2,3 mmol/L.
L’hypoalbuminémie est la cause la plus fréquente de réduction du trou anionique et certains ont fait valoir que dans les populations de patients telles que les malades critiques, qui souffrent fréquemment d’hypoalbuminémie, la correction du trou anionique sérique pour la concentration d’albumine sérique est nécessaire pour une interprétation précise du trou anionique sérique.
L’accumulation anormale d’une protéine sérique individuelle qui a une charge positive nette (cation) a le potentiel de provoquer une réduction du trou anionique. L’immunoglobuline IgG est une de ces protéines cationiques.
Les patients souffrant d’un myélome à IgG produisent de grandes quantités d’IgG monoclonale (paraprotéine) et, en conséquence, présentent fréquemment une réduction du trou anionique. Il existe une corrélation négative entre la concentration de paraprotéine d’IgG monoclonale et le trou anionique , et rarement le trou anionique peut effectivement avoir une valeur négative chez les patients atteints de myélome à IgG . L’augmentation des IgG polyclonales, quelle que soit sa cause, est de même associée à une réduction du trou anionique .
Comme pour la paraprotéinémie à IgG monoclonale, plus l’IgG est élevée, plus le trou anionique est faible. L’augmentation des IgG polyclonales est, par exemple, la cause de la réduction du trou anionique évidente chez les patients infectés par le VIH .
Théoriquement, l’augmentation de la concentration sérique des cations potassium, calcium ou magnésium diminue le trou anionique.
Les augmentations observées dans la pratique clinique sont rarement suffisantes en soi pour réduire le trou anionique en dessous de la limite de l’intervalle de référence, de sorte que l’hyperkaliémie, l’hypercalcémie et l’hypermagnésémie ne sont généralement pas considérées dans le diagnostic différentiel d’un trou anionique réduit.
Cependant, chez les patients présentant une hypoalbuminémie, et chez les patients présentant une élévation des IgG, l’augmentation de l’un de ces cations peut très bien contribuer à la réduction du trou anionique.
Le cation lithium (Li+), normalement non présent dans le sérum, est présent dans le sérum des personnes à qui l’on prescrit du carbonate de lithium, un médicament utilisé pour traiter le trouble bipolaire.
La dose thérapeutique est associée à une concentration sérique de lithium d’environ 1,0 mmol/L, ce qui n’est pas suffisant pour affecter matériellement le trou anionique, mais un surdosage en lithium peut entraîner un trou anionique réduit, voire, en cas d’intoxication grave, un trou anionique négatif . Les principales causes de la réduction du trou anionique sont résumées dans le TABLEAU 1.
Tableau 1 : Causes d’un faible trou d’anions sérique
Les plus fréquentes
Réduction de l’albumine sérique (hypoalbuminémie)
Moins fréquentes
IgG paraprotéinémie myélome
Augmentation des IgG polygonales
Lithium. intoxication
Cause primaire théorique mais rare
Elévation du calcium plasmatique (hypercalcémie)
Elévation du magensum plasmatique (hypermagesémie)
Causes pathologiques de l’élévation du trou anionique
Théoriquement, un trou anionique élevé peut résulter soit d’une diminution des cations non mesurés, soit d’une augmentation des anions non mesurés. En pratique, il résulte presque exclusivement d’une augmentation des anions non mesurés provenant des acides métaboliques. L’acidose métabolique est donc la cause la plus fréquente d’élévation du trou anionique.
La principale anomalie qui caractérise l’acidose métabolique, quelle qu’en soit la cause, est la réduction de la concentration sérique de bicarbonate (HCO3-). Cela peut être dû à une utilisation accrue du bicarbonate pour tamponner une accumulation anormale d’acides, à une perte accrue de bicarbonate par l’organisme ou à une régénération inadéquate du bicarbonate par les reins.
Pour maintenir la neutralité électrochimique, cette réduction de l’anion mesuré (bicarbonate) s’accompagne soit d’une augmentation du chlorure (Cl-) sérique, le seul autre anion mesuré, soit, beaucoup plus fréquemment, d’une augmentation des anions non mesurés.
Dans le premier cas, comme la réduction du bicarbonate mesuré est compensée par l’augmentation du chlorure mesuré, le trou anionique reste inchangé et normal ; ce type d’acidose métabolique est appelé acidose métabolique à trou anionique normal (hyperchlorémique). Dans le second cas, comme il y a une augmentation des anions non mesurés, l’acidose métabolique est appelée acidose métabolique à trou anionique augmenté.
Le trou anionique s’est traditionnellement révélé utile dans le diagnostic différentiel de l’acidose métabolique car, selon la cause, l’acidose métabolique est associée à un trou anionique élevé ou, beaucoup plus rarement, à un trou anionique normal.
Des travaux récents examinés par Kraut & Madias ont révélé que cette utilité du trou anionique n’est pas aussi tranchée qu’on le supposait.
Le sujet principal ici est les causes de l’acidose métabolique à écart anionique accru, mais pour être complet, les causes de l’acidose à écart anionique normal (hyperchlorémique), toutes à l’exception de la diarrhée assez rare, sont énumérées dans le TABLEAU 2.
TABLE 2 : Causes de l’acidose métabolique à trou anion normal (hyperchlorémique)
Diarrhée
Pancréatique, fistules intestinales et biliaires
Acidose des tubules rénaux
Ingestion de chlorure (NH4CI) au minimum
Insuffisance surrénalienne (hypoaldostéronisme)
L’accumulation anormale de tout acide ne contenant pas de chlorure a le potentiel de provoquer une acidose métabolique à écart anionique accru. Comme le bicarbonate est consommé pour tamponner les protons (cation hydrogène) de l’acide, l’anion de l’acide s’accumule, préservant ainsi la neutralité électrochimique. Comme l’anion qui s’accumule n’est pas « mesuré », le trou anionique augmente.
L’accumulation d’acide lactique est probablement la cause la plus courante d’acidose métabolique. Ici, la réduction de la concentration de bicarbonate résultant du tamponnement des protons de l’acide lactique correspond à une augmentation de la concentration de l’anion « non mesuré », le lactate.
L’acidose lactique survient lorsque les tissus sont privés d’oxygène ; elle peut donc survenir dans toute une série de maladies graves (septicémie, infarctus du myocarde, etc.), associées à un collapsus cardiovasculaire (choc), ainsi que dans les traumatismes impliquant une perte de sang importante. Un certain nombre de médicaments, plus particulièrement les biguanides, la metformine et la phenformine, ainsi que l’alcool, peuvent provoquer une acidose lactique.
L’augmentation du lactate est une cause si fréquente d’augmentation du trou anionique, en particulier chez les malades en état critique, que certains ont proposé que le trou anionique facilement disponible soit utilisé comme outil de dépistage de l’augmentation du lactate dans ce groupe de patients .
L’accumulation anormale des acides cétoniques endogènes, l’acide β-hydroxybutyrique et l’acide acétoacétique, est la cause de l’acidose métabolique (cétoacidose) qui se produit dans le diabète non traité et la famine, lorsqu’en l’absence de glucose intracellulaire les graisses sont mobilisées comme source d’énergie alternative.
Dans ce cas, l’augmentation de l’écart anionique est due à l’augmentation de la concentration sérique des anions « non mesurés », le β-hydroxybutyrate et l’acétoacétate.
La diminution de l’excrétion des acides endogènes et de leurs anions est à l’origine de l’acidose métabolique à écart anionique accru qui est fréquemment une caractéristique de l’insuffisance rénale.
L’intoxication par l’éthylène glycol et le méthanol provoque une élévation du trou anionique en vertu de l’acidose métabolique qui résulte de leur métabolisme en acide glycolique et formique, respectivement .
L’acidose pyroglutamique est une cause rare, mais probablement sous-reconnue, d’acidose métabolique à écart anionique élevé . Kortmann et al rapportent trois cas, tous survenus dans le même établissement au cours d’une période de 6 mois.
Le rapport entre la variation du trou anionique et la variation du bicarbonate (∆AG : ∆HCO3) peut être utilisé pour aider à identifier les perturbations acido-basiques coexistantes chez les patients présentant une acidose métabolique.
Cette utilité du trou anionique repose sur la notion qu’en cas d’augmentation pure du trou anionique, d’acidose métabolique (acidose lactique, acidocétose diabétique, etc.), l’incrément du trou anionique par rapport à la normale est égal au décrément du bicarbonate par rapport à la normale, de sorte que le rapport est de 1 . Un rapport ∆AG : ∆HCO3 de
Un rapport de > 1 (augmentation du GA supérieure à la diminution du bicarbonate) suggère soit une alcalose métabolique coexistante, soit une acidose respiratoire coexistante. Kraut & Madias fournit un examen critique de la validité de cette utilisation du trou anionique.
Bien que l’acidose métabolique soit presque invariablement la cause d’une augmentation marquée du trou anionique (c’est-à-dire AG > 25 mmol/L), elle n’est pas nécessairement la cause dans des degrés d’augmentation moins importants (AG 16-20 mmol/L).
Un certain nombre d’autres conditions peuvent donner lieu à une légère augmentation du trou anionique. Une augmentation de l’albumine sérique (hyperalbuminémie) peut augmenter le trou anionique par le même mécanisme que l’albumine sérique réduite (hypoalbuminémie) réduit le trou anionique . De petites augmentations du trou anionique (de l’ordre de 4-6 mmol/L) sont évidentes chez les patients souffrant d’alcalose métabolique non compliquée par d’autres perturbations acido-basiques .
Ceci a permis l’utilisation du trou anionique pour aider à différencier le bicarbonate élevé de l’alcalose métabolique primaire du bicarbonate élevé qui survient lors de la compensation métabolique de l’acidose respiratoire. Dans le premier cas, le trou anionique est élevé et dans le second, le trou anionique est normal.
Par un mécanisme similaire qui explique le trou anionique réduit chez les patients atteints de myélome à IgG, certains patients atteints de myélome à IgA ont un trou anionique élevé . Cela reflète l’observation que certaines paraprotéines sériques IgA sont anioniques, contrairement aux IgG sériques, qui sont des protéines cationiques.
Les causes de l’augmentation du trou anionique sont énumérées dans le TABLEAU 3.
Tableau 3 : Principales causes d’élévation du trou anionique sérique
Associé à une acidose métabolique
Insuffisance rénale
Cétoacidose diabétique
Starvation
.
Cétoacidose alcoolique
Acidose lactique
Intoxication à l’éthylène glycol
Intoxication au méthanol
Intoxication au toluène
Acide pyroglutamique acidose (rare)
Autres affections
Elévation de l’albumine sérique (hyperalbuminémie)
Alcalose métabolique
Myélome à IgA (pas dans tous les cas)
.
SOMMAIRE
Le trou anionique est une information clinique supplémentaire qui peut être facilement dérivée sans coût du profil biochimique le plus couramment demandé, l’urée et les électrolytes (U&E). Il n’est pas possible de calculer le trou anionique si le chlorure sérique n’est pas inclus dans le profil.
La principale utilisation clinique du trou anionique est l’évaluation des perturbations acido-basiques, en particulier l’acidose métabolique. Une augmentation marquée du trou anionique (> 25 mmol/L) est presque invariablement une preuve incontestable d’acidose métabolique.
La distinction entre une acidose métabolique à trou anionique normal et élevé permet au trou anionique d’aider à déterminer la cause primaire de l’acidose métabolique. Le trou anionique a une utilité supplémentaire dans l’investigation des patients qui présentent une acidose métabolique en association avec un autre trouble acido-basique.
La réduction du trou anionique est par comparaison avec l’augmentation du trou anionique une découverte rare qui n’est pas associée à une perturbation de l’équilibre acido-basique, mais qui peut être révélatrice de plusieurs conditions, notamment l’hypoalbuminémie, le myélome et l’intoxication au lithium.
L’interprétation précise des résultats du trou anionique est potentiellement entravée par l’absence de consensus sur la méthode de calcul et la variabilité significative de l’intervalle de référence.
Une erreur de laboratoire (préanalytique ou analytique) dans la mesure de l’un ou de l’ensemble des trois (ou quatre) paramètres nécessaires au calcul peut invalider les résultats du gap anionique. Le gap anionique est donc exceptionnellement vulnérable aux erreurs de laboratoire.