Communication courte – Imagerie en médecine (2018) Volume 10, Numéro 3
Nguyen Minh Duc1,2*, Huynh Quang Huy1, Mai Tan Lien Bang2, LucMinh Truong3, Vo Hoang Tri3, Bui Nguyen Canh3, Pham Ngoc Hoa1, Pham Minh Thong4
1Département de radiologie, Université de médecine Pham Ngoc Thach, Ho ChiMinh ville, Vietnam
2Département de radiologie, Children’shospital 2, Ho Chi Minh ville, Vietnam
3Département de radiologie, SiemensHealthcare Vietnam, Ho Chi Minh ville,Vietnam
4Département de radiologie, Hanoimedical university, Ha Noi, Vietnam
*Auteur correspondant : Nguyen Minh Duc
Département de radiologiePham Ngoc
Thach Université de médecineHo ChiMinh city
Vietnam
E-mail :
Abstract
Basé sur le mouvement brownien, l’état de diffusion de l’hydro-proton à l’intérieur du corps est l’une des variables les plus importantes affectées sur le diagnostic, la planification du traitement et la réponse de la maladie au traitement. Il existe différents types d’imagerie par résonance magnétique pondérée par la diffusion, tels que l’imagerie pondérée par la diffusion, l’imagerie du tenseur de diffusion, l’imagerie du kurtosis de diffusion, l’imagerie du mouvement incohérent intravoxel, l’imagerie de diffusion zoom et l’imagerie du spectre de diffusion. Dans cette courte communication, nous avons voulu présenter les applications cliniques de ces types d’imagerie par résonance magnétique pondérée en diffusion.
Mots-clés
Imagerie pondérée par diffusion ▪ imagerie par résonance magnétique ▪ applications cliniques
Introduction
Selon le principe du mouvement brownien (figure 1), l’état de diffusion, l’une des caractéristiques les plus essentielles des tissus, peut être évalué de manière non ionisante au moyen de l’imagerie par résonance magnétique (IRM). Actuellement, nous disposons de plusieurs séquences d’imagerie de diffusion pour obtenir des variables liées à la diffusion, telles que l’imagerie pondérée en diffusion (DWI), l’imagerie du capteur de diffusion (DTI), l’imagerie du kurtosis de diffusion (DKI), l’imagerie du mouvement incohérent intravoxel (IVIM), l’imagerie pondérée en diffusion zoom (Z-DWI) et l’imagerie du spectre de diffusion (DSI). Dans cette courte communication, nous avons voulu présenter les applications cliniques de ces types d’IRM pondérée par diffusion.

Figure 1. Mouvement brownien.
■ DWI
La DWI est la forme la plus populaire d’IRM de diffusion basée sur la mesure du mouvement brownien des molécules d’eau au sein du tissuvoxel. Contrairement au mouvement de diffusion libre de l’eau dans une bouteille, la diffusion à l’intérieur d’un tissu est essentiellement limitée par les marges de la membrane cellulaire.La caractéristique de diffusion globale d’un seul voxelreprésente la combinaison de la diffusion de l’eau dans différents compartiments : diffusion avec le fluide de l’espace intracellulaire (le cytoplasme et les organites) ; diffusion dans le fluide de l’espace extracellulaire (fluide interstitiel, intravasculaire, lymphatique et diverses cavités biologiques) etdiffusion entre les espaces intra et extracellulaires.Par conséquent, l’augmentation de l’intensité des tissus cellulaires, des substances étranges, des particules lourdes à l’intérieur de ces espaces entraînera la limitation des coefficients de diffusion .
Le coefficient de diffusion apparent (ADC) est une mesure de l’ampleur de la diffusion des molécules d’eau à l’intérieur des tissus. Cette évaluation peut être étudiée à l’aide de valeurs b différentes en modifiant l’amplitude du gradient – généralement des valeurs b de 0 et 1000 s/mm2. L’ADC est obtenu automatiquement par le logiciel et se présente ensuite comme une carte paramétrique qui démontre le niveau de diffusion de l’eau des molécules des différents tissus. L’ADC des tissus est introduit en unités de mm2/s .La DWI est spécifiquement efficace pour caractériser une tumeur(figure 2) et évaluer un infarctus cérébral (figure3).
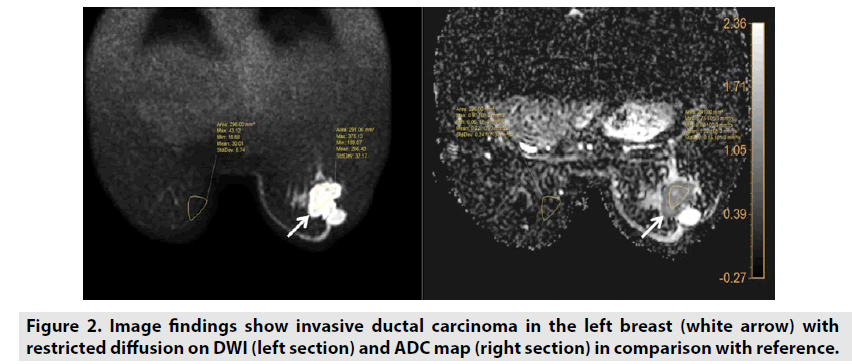
Figure 2. Les résultats d’image montrent un carcinome canalaire invasif dans le sein gauche (flèche blanche) avec une diffusion restreinte sur DWI (section gauche) et une carte ADC (section droite) en comparaison avec la référence.
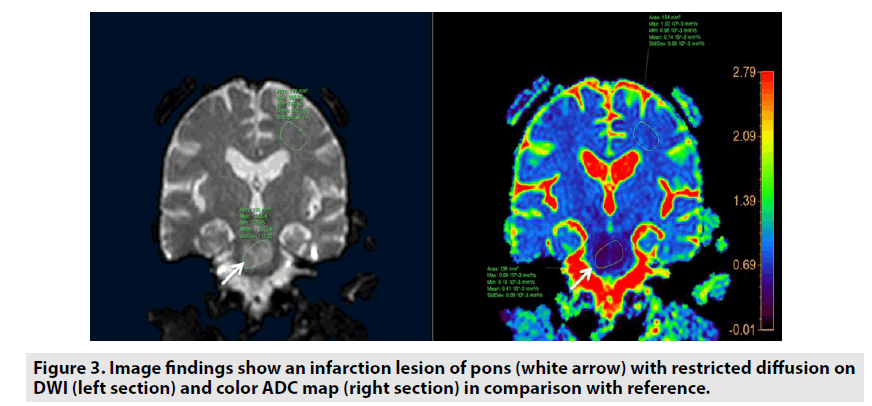
Figure 3. Les résultats de l’image montrent une lésion d’infarctus du pons (flèche blanche) avec une diffusion restreinte sur laDWI (section gauche) et la carte ADC couleur (section droite) en comparaison avec la référence.
■ IVIM
Denis Le Bihan a utilisé pour la première fois le terme IVIMpour démontrer le mouvement de translation microscopique des molécules d’eau dans un voxel. Dans le modèle IVIM, le tissu biologique est constitué de deux compartiments apparents : la diffusion des molécules d’eau dans les tissus, considérée comme une véritable diffusion, et la microcirculation du sang dans le réseau capillaire, considérée comme une perfusion. Ainsi, Denis Le Bihan a introduit que l’écoulement de l’eau au niveau intravoxel imite un mouvement désordonné considéré comme une pseudo-diffusion.De même que pour la diffusion des molécules d’eau, l’effet de la pseudo-diffusion sur l’atténuation du signalNéanmoins, le niveau d’atténuation du signal causé par la pseudo-diffusion est généralement supérieur d’un ordre de grandeur à la diffusion moléculaire du tissu, par conséquent son ajout respectif au signal DWI ne devient important qu’à une valeur b très faible, généralement inférieure à une valeur b de 200 s/mm2, ce qui permet de distinguer les effets de diffusion et de perfusion.En pratique, l’IVIM a été utilisé pour obtenir 4 paramètres : En pratique, l’IVIM a été utilisée pour obtenir 4 paramètres : F (fraction de perfusion), D* (pseudo-diffusion), D (diffusion réelle) et ADC (Figure 4). L’IVIM est très utile pour évaluer les caractéristiques de la tumeur et les réponses de la tumeur au traitement .
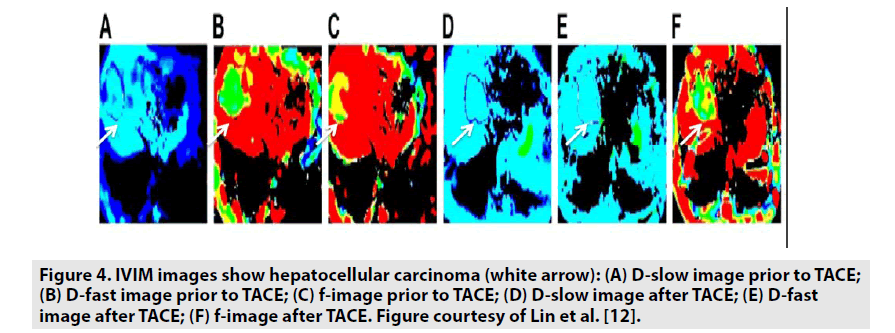
Figure 4. Les images IVIM montrent un carcinome hépatocellulaire (flèche blanche) : (A) image D-lente avant TACE ;(B) image D-rapide avant TACE ; (C) image f avant TACE ; (D) image D-lente après TACE ; (E) image D-rapide après TACE ; (F) image f après TACE. Figure reproduite avec l’aimable autorisation de Lin et al.
■Z-DWI
La DWI conventionnelle, lorsqu’elle évalue une structure sophistiquée, ne produit généralement pas une résolution spatiale suffisante. En outre, la DWI conventionnelle est très sensible aux mouvements du corps et à la structure paramagnétique, ce qui entraîne une distorsion géométrique. Pour surmonter ce problème, la Z-DWI est une nouvelle forme de DWI conventionnelle combinée à une haute résolution, même dans un petit champ de vision, qui peut aider le clinicien à étudier les lésions de structures sophistiquées telles que l’hippocampe, la moelle épinière ou un stade précoce d’astrocytome survenu dans un petit gyrus (Figure 5). La Z-DWI est cliniquement indiquée pour l’épilepsie, la caractérisation de la lésion de l’hippocampe, la lésion de la moelle épinière et l’évaluation de la tumeur cérébrale .

Figure 5. L’image Z-DWI montre le gyrus asymétrique de l’hippocampe gauche (flèche blanche) en comparaison avec le gyrus normal de l’hippocampe droit.
■DTI
La DTI est une expansion de la DWI qui permet le contourage des données en fonction du tractus tissulaire, en particulier la direction d’extension de la matière blanche.L’architecture de l’axone en faisceaux parallèles sans armure de myéline facilite la diffusion des molécules d’eau dans la même direction principale (figure 6). Le suivi des fibres, également connu sous le nom d’abstraction, se base sur la DTI pour suivre les fibres dans toute leur direction. À partir d’une région d’intérêt, généralement définie manuellement, l’algorithme de suivi des fibres recherche les voxels adjacents dont la direction principale de diffusion est dans la continuité de la précédente. Le faisceau de fibres le plus couramment suivi est celui du corticospinal. En outre, la DTI produit également deux paramètres : ADC et l’anisotropie fractionnelle (FA)également connue sous le nom d’anisotropie de diffusion (Figure 7).En pratique, l’application de la DTI concerne le cerveau comme la localisation spécifique des lésions de la matière blanche, la localisation des tumeurs par rapport aux trajets de la matière blanche, la localisation des principaux trajets de la matière blanche pour la planification neurochirurgicale et l’évaluation de la maturation de la matière blanche ;néanmoins, aujourd’hui, la DTI peut être appliquée à certains autres organes comme le rein, l’utérus, le muscle et le cœur.

Figure 6. Les images DTI montrent des faisceaux de matière blanche : (A) Plan axial, (B) Plan coronal, (C) Plan sagittal.

Figure 7. L’image DTI montre la tractographie des faisceaux cortico-spinaux, FA et ADC.
■DKI
La DKI est une méthode avancée qui est uneextension de la DTI en mesurant la distribution asymétrique, également connue sous le nom de kurtosis de la diffusion de l’eau reposant sur une capacité de fonction de distribution. Le kurtosis est une statistique courante, sans dimension, qui permet de quantifier les mouvements non gaussiens en fonction de la différence entre une distribution normale et une distribution anormale. Il génère une diffusion d’ordre élevé de la distribution et de l’analyse de l’eau. En outre, l’ICD peut quantifier la restriction de diffusion avec plus de précision que l’ITD (figure 8). Les protocoles d’ICD diffèrent des protocoles d’ITD en ce qu’ils utilisent au moins 3 valeurs b, contre 2 pour l’ITD, et au moins 30 directions indépendantes du gradient de diffusion, contre 6 pour l’ITD. Les protocoles d’ITD pour le cerveau nécessitent des valeurs b de 0, 1000, 2000 s/mm2 avec des extensions de diffusion. Le post-traitement de l’image nécessite l’utilisation d’algorithmes spécialisés. L’ICD est couramment utilisée pour évaluer les accidents vasculaires cérébraux et les tumeurs cérébrales. Avec les organes extérieurs au cerveau, certaines études antérieures ont démontré l’efficacité de l’ICD.
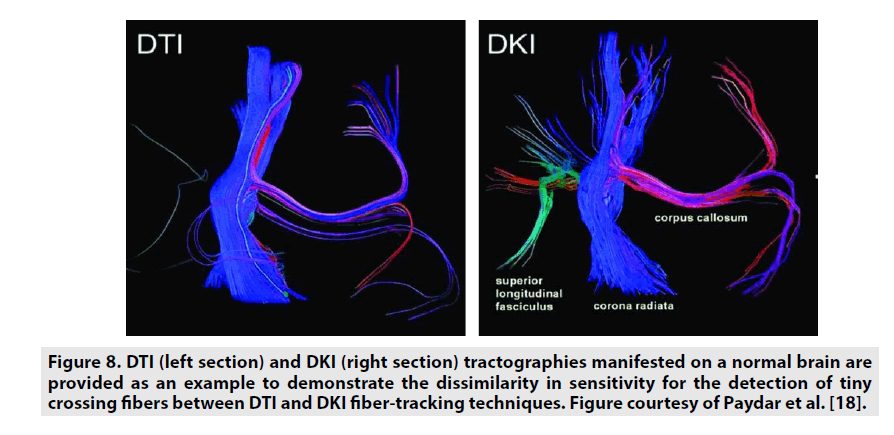
Figure 8. Les tractographies DTI (section gauche) et DKI (section droite) manifestées sur un cerveau normal sont fournies à titre d’exemple pour démontrer la dissemblance de sensibilité pour la détection des fibres tinycrossing entre les techniques de suivi des fibres DTI et DKI. Figure gracieusement fournie par Paydar et al.
■DSI
Le modèle DTI a révélé qu’il existe une direction intravoxel exclusive de chaque fibre symbolisée par le vecteur propre principal. Cependant,on conclut qu’en cas de croisement de fibres représentant communément les zones dans lesquelles la direction des fibres n’est pas similaire, c’est-à-dire lorsque les fibres s’interdigitent, se caressent, se courbent, s’orbitent les unes par rapport aux autres, la DTI n’est pas valide (figure 9). Récemment, des modèles plus robustes du processus de diffusion ont été proposés afin de surmonter les inconvénients du modèle DTI, parmi lesquels le DSI est l’une des meilleures solutions. DSIaméliore la précision en cas de croisement de fibres et produit également une haute résolution et un détail profond des faisceaux de fibres par rapport à la DTI(Figure 10).
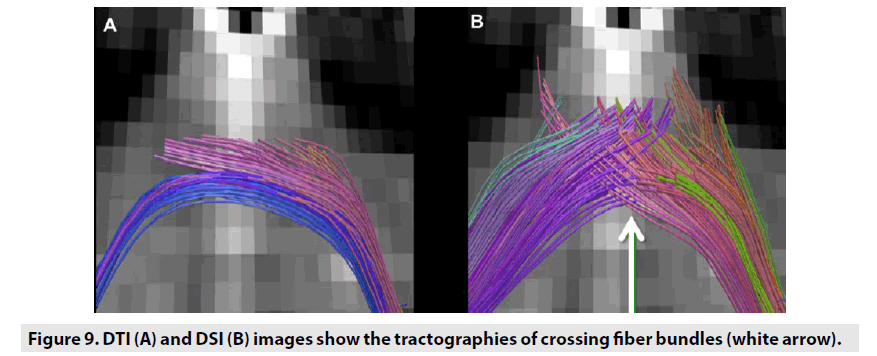
Figure 9. Les images DTI (A) et DSI (B) montrent les tractographies des faisceaux de fibres qui se croisent (flèche blanche).

Figure 10. L’image DSI montre des faisceaux de matière blanche entiers et détaillés.
■Avantage et inconvénient
Le plus grand avantage des séquences DWI est la valeur des paramètres quantitatifs reflétant la vitesse du mouvement du proton et la forme du mouvement du proton à l’intérieur du tissu. Avec les techniques innovantes actuelles, l’IVIM reflète également de manière partielle la caractéristique de perfusion des tissus . En plus de la DTI, la DKI et la DSI peuvent améliorer le taux de précision dans l’examen des nerfs, des muscles et même des faisceaux de tissus, réduisant ainsi les faux positifs et négatifs du diagnostic.
Pour résoudre la faible résolution temporelle, la Z-DWI est essentielle pour évaluer la structure sophistiquée comme les petits gyrus, l’hippocampe et la prostate . Toutes ces techniques sont sans exposition au gadolinium et peuvent donc être reproduites sans risque de lésions rénales ou de rétention de gadolinium. Ces techniques sont très utiles chez les enfants, les patients âgés, les personnes souffrant d’insuffisance rénale et les patients présentant un risque élevé d’allergie au gadolinium. Néanmoins, les techniques DWI sont plus performantes dans les IRM d’au moins 1,5Tesla avec les logiciels d’analyse correspondants. En outre, la DSI a tendance à être plus performante dans les IRM d’au moins 3 Tesla et la DKI doit être évaluée avec un laboratoire mathématique en corrélation avec un modèle bi-exponentiel, tri-exponentiel ou complexe. En termes d’investigation sur les caractéristiques physiologiques et biologiques des tissus, les techniques innovantes de DWI sont plus prospères et rigoureuses que la DWI conventionnelle enmanufacturant plus d’informations pour gérer le diagnostic confidentiel, le traitement approprié et la réponse des lésions aux méthodes thérapeutiques.
Conclusion
L’imagerie par résonance magnétique de diffusion a des types dissemblables qui peuvent faciliter et produire des informations utiles aux cliniciens pour optimiser le diagnostic et la stratégie de traitement. En plus de la DWI et de la DTI conventionnelles, de nouvelles méthodes telles que l’IVIM, la Z-DWI, la DKI et la DSI sont développées pour améliorer la précision du diagnostic et des stratégies de traitement thérapeutique, qui doivent donc être étudiées avec soin.
Déclaration de confidentialité
Luc Minh Truong, Vo Hoang Tri et BuiNguyen Canh sont des employés de Siemens.Néanmoins, le garant scientifique de cettepublication est le Dr Nguyen Minh Duc et le DrHuynh Quang Huy, Département de radiologie,Université de médecine Pham Ngoc Thach.Nguyen Minh Duc et Huynh Quang Huyont contribué à parts égales à cet article. Tous les auteurs ont lu et approuvé le manuscrit. Les auteurs de ce manuscrit ne signalent aucun conflit d’intérêts.
- Brown R.Un bref compte rendu des observations microscopiques faites au cours des mois de juin, juillet et août 1827 sur les particules contenues dans le pollen des plantes ; et sur l’existence générale de molécules actives dans les corps organiques et inorganiques.Philosoph. Mag. Ann. Philosophie. 4, 1-16 (1828).
- Einstein A.Uber die von der molekularkinetischen Theorie der Wärme geforderteBewegung von in ruhenden Flussigkeiten suspendierten Teilchen. Annalen. Der. Physik. 322, 549-560 (1905).
- Le Bihan D, E Breton. Imagerie de diffusion in-vivo par résonance magnétique nucléaire.Acad. Sci.301, 1109-1112 (1985).
- Malayeri AA,El Khouli RH,Zaheer A et al. Principes et applications de l’imagerie pondérée par diffusion dans la détection, la stadification et le suivi du traitement du cancer. Radiographics. 31, 1773-1791 (2011).
- Minati L, Weglarz WP.Fondements physiques, modèles et méthodes de l’imagerie par résonance magnétique de diffusion du cerveau : Une revue. Concepts. Magn. Reson. 30A, 278-307 (2007).
- Baliyan V, Das CJ, Sharma R et al. Imagerie pondérée par diffusion : Technique et applications. World. J. Radiol. 8, 785-798 (2016).
- Le Bihan D, Breton E, Lallemand D et al. Imagerie par RM des mouvements incohérents intravoxels : application à la diffusion et à la perfusion dans les troubles neurologiques.Radiologie.161, 401-407 (1986).
- Le Bihan D, Breton E, Lallemand D et al. Séparation de la diffusion et de la perfusion dans l’imagerie par RM des mouvements incohérents intravoxels.Radiology.168, 497-505 (1988).
- Du J, Li K, Zhang W et al.Intravoxel incoherent motion MR imaging : comparison of diffusion and perfusion characteristics for differential diagnosis of soft tissue tumors. Médecine. 94, 1-8 (2015).
- Lima M, Le Bihan D.Imagerie RM clinique de mouvement incohérent intravoxel et de diffusion : passé, présent et futur. Radiology. 278, 13-32 (2016).
- Koh DM, Collins DJ, Orton MR.Intravoxel incoherent motion in body diffusion-weighted MRI : reality and challenges. AJR. Am. J. Roentgenol. 196, 1351-1361 (2011).
- Lin M,Tian MM,Zhang WPet al.Valeurs prédictives de l’imagerie pondérée en diffusion et de l’imagerie pondérée en perfusion dans l’évaluation de l’efficacité de la chimioembolisation artérielle transcathéter pour le carcinome hépatocellulaire. Onco. Targets. Ther. 14, 7029-7037 (2016).
- Saritas EU, Cunningham CH, Lee JH, et al.DWI de la moelle épinière avec un FOV réduit en single-shot EPI. Magn. Reson. Med. 60, 468-473 (2008).
- Wilm BJ, Svensson J, Henning A et al.Reduced field-of-view MRI using outer volume suppression for spinal cord diffusion imaging. Magn. Reson. Med. 57, 625-630 (2007).
- Samson RS,Levy S,Schneider T et al. ZOOM or Non-ZOOM ? Évaluation des protocoles d’imagerie par tenseur de diffusion de la moelle épinière pour les études multicentriques. PLoS. ONE. 12, 11 (2016).
- Hagmann P,Jonasson L,Maeder P et al. Comprendre les techniques d’imagerie RM de diffusion : de l’imagerie scalaire pondérée en diffusion à l’imagerie du tenseur de diffusion et au-delà. Radiographics. 26, 205-223 (2006).
- Mukherjee P, Berman JI, Chung SW et al.Diffusion tensor MR imaging and fiber tractography : theoretic underpinnings. AJNR. Am. J. Neuroradiol. 29, 632-640 (2008).
- Paydar A,Fieremans E,Nwankwo JI et al.Imagerie du kurtosis de diffusion du cerveau en développement. AJNR. Am. J. Neuroradiol. 35, 808-814 (2014).
- Tournier JD, Mori S, Leemans A.Diffusion tensor imaging and beyond. Magn. Reson. Med. 65, 1532-1556 (2011).
- Jensen JH, Helpern JA, Ramani A et al.Diffusional kurtosis imaging : the quantification of non-Gaussian water diffusion by means of magnetic resonance imaging. Magn. Reson. Med. 53, 1432-1440 (2005).
- Jensen JH, Helpern JA.MRI quantification of non-gaussian water diffusion by kurtosis analysis. RMN. Biomed. 23, 698-710 (2010).
- Weeen VJ, Wang RP, Schmahmann JD et al.Tractographie des fibres croisées par l’imagerie par résonance magnétique à spectre de diffusion.NeuroImage.41, 1267-1277 (2008).
- Weeen V, Hagmann P, Tseng WY et al.Cartographie de l’architecture complexe des tissus avec l’imagerie par résonance magnétique à spectre de diffusion. Magn. Reson. Med. 54, 1377-1386 (2005).
- Glenn GR, Kuo L-W, Chao Y-P et al.Mapping the orientation of white matter fiber bundles : a comparative study of diffusion tensor imaging, diffusional kurtosis imaging, and diffusion spectrum imaging. AJNR. Am. J. Neuroradiol. 37, 1216-1222 (2016).