Todos sabemos muy bien lo que es el calor y lo que es capaz de hacer. Pero, el calor específico es un concepto que muy poca gente conoce. Además, utilizamos el calor específico para elevar la temperatura de un objeto en grados. Además, en este tema hablaremos del calor específico, la fórmula del calor específico, su derivación y ejemplos resueltos. Además, el calor específico de los distintos elementos difiere entre sí.
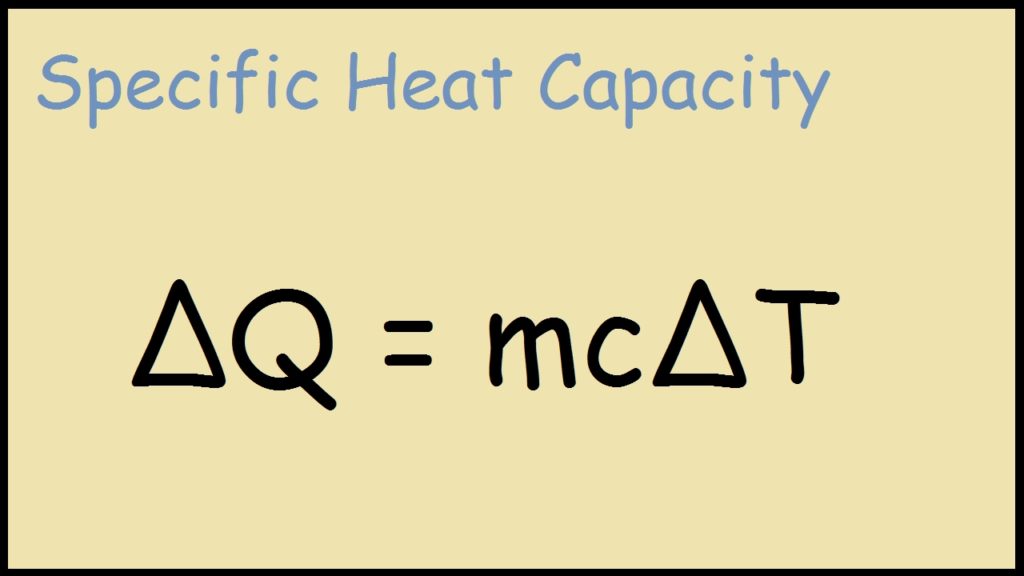
Fuente: YouTube
Calor específico
El calor específico se refiere a la relación entre la cantidad de calor que necesitamos para elevar la temperatura de un cuerpo en un grado que necesitamos para aumentar la temperatura de una masa equivalente de líquido (agua) en un grado. También, utilizamos el término en un sentido más restringido para referirnos a la cantidad de calor, en calorías que requerimos para elevar la temperatura de un gramo de una sustancia en un grado Celsius.
En palabras sencillas, es la relación entre la cantidad de calor requerida para aumentar la temperatura de un objeto en un grado y la cantidad de calor requerida para aumentar la temperatura de la misma cantidad de agua en un grado.
Obtén la enorme lista de Fórmulas de Física aquí
Fórmula del Calor Específico
Como hemos comentado anteriormente el calor específico es la relación de cambio de temperatura de un objeto con el agua.
Además, la fórmula es así:
Energía calorífica = (masa del objeto o sustancia) × (calor específico) × (Cambio de temperatura)
Q = m × c × \(\Delta T\)
O
Q = \(mc\Delta T\)
Derivación de la Fórmula del Calor Específico
Ejemplos resueltos sobre la Fórmula del Calor Específico
Ejemplo 1
Si el calor específico del oro es de 129 \(J/kg\cdot k\). Entonces, ¿qué cantidad de energía calorífica es necesaria para elevar la temperatura de 100 g de oro en 50,0 K?
Solución:
Cálculo:
Q = \(mc\cdelta T\)
Q = (0,100 kg) (129 \cdot k\)) (50,0 K)
Entonces, la energía necesaria para elevar la temperatura de 100 g de oro es de 645 J.
Ejemplo 2
Supongamos que una olla se calienta transfiriendo 1676 KJ de energía calorífica al agua. Además, si hay 5.000 kg de agua en la olla y la temperatura se eleva en 80,0 K entonces halla el calor específico del agua?
Solución:
Escribamos las cosas dadas en la pregunta
Masa (m) = 5,00 kg
Temperatura (T) = 80.0 K
Calor específico (c) = 1676 KJ
Ahora tenemos que convertir el calor específico en Julios porque está en Kilojulios.
Entonces, la conversión es así
1 KJ = 1.000 J
Entonces, 1676 KJ = 1.000 × 1676 = 16.76.000 J
Ahora pon todos los valores en la fórmula. Pero, antes, tenemos que reorganizar la fórmula para encontrar el calor específico.
Q = \(mc\Delta T\) \(\rightarrow\) c = \(\frac{Q}{m\Delta T}\)
Ahora poner los valores en la fórmula reordenada
C = \(\frac{1676000} {(5.00 kg)(80,0)}\N)
C = 4190 \N(J/kg\cdot k\)
Por lo tanto, el calor específico del agua es 4190 \N(J/kg\cdot k\).