US Pharm. 2020;45(6):30-32.
ABSTRACT: La FDA define un medicamento genérico como un «medicamento creado para ser el mismo que un medicamento de marca ya comercializado en cuanto a forma de dosificación, seguridad, potencia, vía de administración, calidad, características de rendimiento y uso previsto.» El sistema sanitario estadounidense ahorró casi 2 billones de dólares entre 2009 y 2019 en costes sanitarios gracias al uso de genéricos, con un ahorro mayor cada año. A pesar de esta variación en el coste, barreras como la falta de comunicación y educación, los efectos secundarios previos o la preferencia pueden desempeñar un papel en el uso continuado de los medicamentos de marca. El aumento del mercado de productos genéricos creará competencia y, en última instancia, conducirá a una reducción de los precios de los medicamentos y al acceso a una asistencia sanitaria asequible para más pacientes. Es importante que los farmacéuticos eduquen a los pacientes y a los proveedores sobre el uso adecuado de los medicamentos genéricos frente a los de marca.
La FDA define un medicamento genérico como un «medicamento creado para ser el mismo que un medicamento de marca ya comercializado en cuanto a forma de dosificación, seguridad, potencia, vía de administración, calidad, características de rendimiento y uso previsto».1,2 Los medicamentos genéricos, por tanto, son equivalentes a los productos de marca en términos de eficacia, calidad y seguridad. Las solicitudes abreviadas de nuevos fármacos (ANDA) para la aprobación de genéricos deben demostrar la bioequivalencia y que el principio activo es el mismo que el de marca; pueden diferir en función de los ingredientes inactivos, pero debe demostrarse que estas diferencias no afectan al funcionamiento del medicamento.1-3
La Ley de Competencia de Precios de Medicamentos y Restauración de la Duración de las Patentes de 1984, o Ley Hatch-Waxman, permitió que los genéricos fueran aprobados para su uso en el mercado sin necesidad de realizar pruebas preclínicas y clínicas para garantizar que un genérico tuviera un coste menor en comparación con su producto de marca equivalente. Los genéricos tienen un coste entre un 80% y un 85% menor en comparación con su producto de marca.1 Según los datos de IQVIA 2019, el sistema sanitario estadounidense ahorró casi 2 billones de dólares entre 2009 y 2019 gracias al uso de genéricos, con un ahorro mayor cada año.4,5 Según un informe de la Asociación de Medicamentos Accesibles (AAM), en 2018 se dispensaron 4.000 millones de recetas genéricas en EE. UU, lo que representó el 90 % de las recetas surtidas en los EE. UU. Sin embargo, esto solo representó el 22 % de todo el gasto en medicamentos.5
Debido a las percepciones o a las experiencias pasadas con los medicamentos genéricos, algunos consumidores continúan utilizando medicamentos de marca a pesar de esta diferencia en el costo, lo que puede conducir a un aumento en el gasto de los consumidores, la insatisfacción de los pacientes y, en última instancia, una disminución en la adherencia. Responder a las preguntas o discutir el uso de los medicamentos genéricos frente a los de marca o los ingredientes inactivos frente a los activos con los pacientes es un papel importante para los farmacéuticos para ayudar a mejorar la satisfacción del paciente, la adherencia y la calidad de vida. El aumento del mercado de productos genéricos creará competencia y, en última instancia, conducirá a una reducción de los precios de los medicamentos y al acceso a una asistencia sanitaria asequible para más pacientes.1
Puntos de debate
Debido a las ideas erróneas y a la falta de comprensión de la diferencia entre los productos de marca y los genéricos, es vital educar a los pacientes sobre los hechos. En los siguientes párrafos se exponen conceptos de discusión que pueden ser importantes para nuestros pacientes.
¿Cuál es la diferencia entre ingredientes activos e inactivos?
Un ingrediente activo es el componente del medicamento que produce el efecto farmacológico en el cuerpo. Los ingredientes activos pueden sufrir cambios químicos a medida que se fabrica el producto y estar presentes en una forma modificada para que puedan proporcionar su efecto.6 Un ejemplo de esto sería una formulación de liberación prolongada de un medicamento. Un ingrediente inactivo es un componente del fármaco que no afecta a la acción terapéutica del medicamento en el organismo. Los ingredientes inactivos se añaden a un producto farmacéutico para ayudar a ligar, aromatizar, colorear, conservar o transportar el medicamento. Algunos ejemplos de ingredientes inactivos son el alcohol, la gelatina, la galactosa, la lactosa y la sacarina.
Para obtener la aprobación de la FDA, un medicamento genérico debe contener el mismo principio activo que el medicamento original (es decir, el producto de marca). Aunque los ingredientes inactivos pueden ser diferentes, la FDA lleva a cabo regularmente extensas revisiones de los productos genéricos para asegurarse de que cumplen las normas. La FDA entiende que puede haber variabilidad en cada lote fabricado, pero la cantidad de variabilidad es limitada. Esta variabilidad puede producirse entre los medicamentos de marca y los genéricos, pero también puede tener lugar entre las marcas, debido a ligeras diferencias en la fabricación de los lotes.1 La FDA también investiga los efectos secundarios notificados con un producto de marca o genérico para determinar si se necesitan cambios en la fabricación.
¿Cuál es la diferencia entre un producto genérico y un genérico autorizado?
Un producto genérico es el equivalente de un producto de marca fabricado por una empresa distinta de la que fabrica el producto de marca. Un genérico autorizado, sin embargo, puede ser comercializado por la empresa del medicamento de marca o la empresa con el permiso de la marca pero como un genérico a un coste menor. Los genéricos autorizados son iguales que el medicamento de marca en el sentido de que tienen los mismos ingredientes activos e inactivos, pero su aspecto puede ser diferente.7 Un genérico autorizado puede no figurar en el listado de medicamentos genéricos de la FDA, conocido como Libro Naranja, ya que se comercializa bajo la Solicitud de Nuevo Medicamento de la marca frente a los productos genéricos, que se aprueban tras la presentación de una ANDA.7,8
Tanto los genéricos como los genéricos autorizados pueden tener un coste inferior en comparación con los medicamentos de marca, ya que los fabricantes de genéricos no tienen que completar los ensayos clínicos que se requerían para los productos de marca.
¿Hay que tener en cuenta algo al cambiar de un producto de marca a uno genérico?
Los medicamentos de marca y los genéricos no pueden tener el mismo aspecto, debido a las leyes de marcas registradas en EE.UU. Las diferencias de color, forma, tamaño y sabor, sin embargo, no influyen en la forma en que funcionan los medicamentos. Como se ha dicho anteriormente, la variabilidad se produce en los lotes, pero a niveles muy pequeños y no significativos. Por ejemplo, un amplio estudio que comparaba los medicamentos genéricos con los de marca encontró pequeñas diferencias de sólo un 3,5% en la absorción en el organismo entre los medicamentos genéricos y los de marca.9
Posibles barreras para la prescripción de genéricos y formas de superarlas
A lo largo de los años se han realizado encuestas y estudios para analizar las barreras en el uso de genéricos o el aumento de los cambios de genéricos a marca. La TABLA 1 proporciona una lista de posibles barreras para la prescripción y dispensación de genéricos.10-15

Una encuesta realizada en pacientes epilépticos y sus preocupaciones sobre las sustituciones de genéricos concluyó que los pacientes creían que los cambios sólo debían ser determinados por el proveedor o el paciente. Estas preocupaciones se derivaban de la inquietud de los proveedores de que se produzcan convulsiones al cambiar o de que aumente el riesgo de efectos secundarios, y de la preocupación de los pacientes de que los genéricos no proporcionen una eficacia o tolerabilidad equivalentes.16 Sin embargo, también se ha demostrado que tener una relación con el farmacéutico y hacer que el proveedor y los pacientes estén al tanto de los cambios del fabricante puede ayudar a mejorar el uso de los genéricos en los pacientes epilépticos.17
Además, algunos clínicos y científicos han expresado su preocupación por la aprobación de la bioequivalencia por parte de la FDA. Sin embargo, el Comité Coordinador de la Acción de Inequivalencia Terapéutica, un grupo de revisión posterior a la comercialización de la FDA, identifica y evalúa los informes de fracasos terapéuticos para determinar si es necesaria la retirada de los productos no equivalentes.9 Además, los estudios han concluido que las pruebas de bioequivalencia exigidas por la FDA son sólidas y ayudan a respaldar la aprobación de que los medicamentos de marca y los genéricos son terapéuticamente equivalentes.9
Los estudios han revisado las tasas de switchback o la cantidad de veces que los pacientes vuelven a los medicamentos de marca desde los genéricos a pesar de la diferencia de costes. Los estudios que revisaron los genéricos autorizados y los genéricos mostraron una menor tasa de cambios de marca debido a las intervenciones para mejorar la comunicación y la educación sobre la equivalencia de los genéricos y los productos de marca.11,12 Además, las similitudes en la apariencia también impidieron los cambios de marca.11
Debido a las recientes retiradas de productos genéricos, los pacientes también pueden ser aprensivos a cambiar a los genéricos ya que pueden no ser producidos en los EE.UU., creyendo que los medicamentos fabricados fuera de los EE.UU. no son seguros, a pesar de la aprobación de la FDA. Una educación adecuada sobre los detalles de las retiradas es eficaz para fomentar la adherencia a los medicamentos.14
A pesar de la disponibilidad de un medicamento genérico, el uso de un producto de marca puede ser clínicamente apropiado en determinadas situaciones. Por ejemplo, los pacientes anteriores que toman medicamentos para la epilepsia y que experimentaron un aumento en la frecuencia de las convulsiones con un cambio de genérico pueden ser apropiados para un cambio a un medicamento de marca para el control de las convulsiones.15
Con las diversas barreras discutidas anteriormente, múltiples estudios han demostrado que la promoción de intervenciones educativas para los pacientes y los proveedores puede ayudar a aumentar la confianza en el uso de genéricos.13 Además, educar sobre el uso de genéricos puede ayudar a mejorar la calidad de la atención y la adherencia a los medicamentos. El informe de la AAM de 2019 analizó las tasas de abandono de medicamentos, examinando la tasa en la que los pacientes pueden no tomar o recoger sus medicamentos a pesar de solicitar la receta. El informe concluye que las tasas de abandono de los nuevos pacientes son un 266% más altas para los medicamentos de marca cuando se comparan con los genéricos.5 Los copagos jugaron un papel importante en esta tasa de abandono; el 90% de los copagos de los genéricos fueron inferiores a 20 dólares, en comparación con el 39% de los medicamentos de marca.5
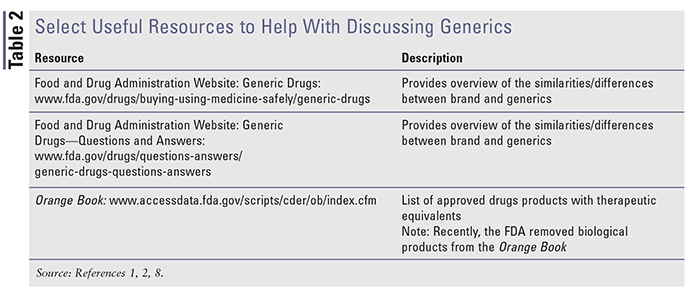
Recursos disponibles para ayudar a la educación
Hay múltiples recursos disponibles para ayudar a entender y discutir la marca y los genéricos. Por favor, consulte la TABLA 2 para obtener una visión general de algunos recursos útiles disponibles.
CONCLUSIÓN
Como farmacéuticos, nos comprometemos a aplicar nuestros conocimientos para asegurar resultados óptimos para nuestros pacientes y abogar por cambios que mejoren la atención al paciente. Mejorar la adherencia, educar a nuestros pacientes en los hechos y tener una comunicación abierta con los proveedores sobre la información es vital para que podamos cumplir con nuestro juramento como farmacéutico. La FDA lleva a cabo un riguroso proceso para aprobar los medicamentos genéricos en el mercado estadounidense; sin embargo, debido a las percepciones o a la cantidad de información viable, los pacientes pueden ser aprensivos a la hora de tomar medicamentos genéricos. Los estudios han demostrado que superar las barreras y educar a los pacientes y a los proveedores sobre los hechos de los genéricos frente a los de marca puede ayudar a mejorar la prescripción de genéricos y, en última instancia, ayudar a producir una asistencia sanitaria asequible.
1. FDA. Medicamentos genéricos. www.fda.gov/drugs/buying-using-medicine-safely/generic-drugs. Consultado el 19 de marzo de 2020.
2. FDA. Medicamentos genéricos: preguntas y respuestas. www.fda.gov/drugs/questions-answers/generic-drugs-questions-answers. Accessed March 19, 2020.
3. Dunne S, Shannon B, Dunne C, Cullen W. A review of the differences and similarities between generic drugs and their originator counterparts, including economic benefits associated with usage of generic medicines, using Ireland as a case study. BMC Pharmacol Toxicol. 2013;14:1.
4. IQVIA Institute for Human Data Science. Global medicine spending and usage trends: outlook 2024. www.iqvia.com/-/media/iqvia/pdfs/institute-reports/global-medicine-spending-and-usage-trends.pdf?_=1586623006517. Consultado el 20 de marzo de 2020.
5. Asociación para los Medicamentos Accesibles. El caso de la competencia: informe de 2019 sobre el acceso a los medicamentos genéricos y biosimilares y el ahorro en los Estados Unidos. https://accessiblemeds.org/sites/default/files/2019-09/AAM-2019-Generic-Biosimilars-Access-and-Savings-US-Report-WEB.pdf. Consultado el 20 de marzo de 2020.
6. FDA. Aprobación de medicamentos y bases de datos: ingrediente inactivo. www.fda.gov/drugs/drug-approvals-and-databases/inactive-ingredient-search-approved-drug-products-frequently-asked-questions. Consultado el 20 de marzo de 2020.
7. FDA. Solicitud abreviada de nuevo medicamento (ANDA): Lista de medicamentos genéricos autorizados por la FDA. www.fda.gov/drugs/abbreviated-new-drug-application-anda/fda-list-authorized-generic-drugs. Consultado el 21 de marzo de 2020.
8. FDA: Libro Naranja: productos farmacéuticos aprobados con evaluaciones de equivalencia terapéutica. www.accessdata.fda.gov/scripts/cder/ob/index.cfm. Consultado el 21 de marzo de 2020.
9. Davit BM, Nwakama PE, Buehler GJ, et al. Comparación de medicamentos genéricos e innovadores: una revisión de 12 años de datos de bioequivalencia de la Administración de Alimentos y Medicamentos de los Estados Unidos. Ann Pharmacother. 2009;43(10):1583-1597.
10. Choudhry NK, Denberg D, Qaseem A. Improving adherence to therapy and clinical outcomes while containing costs: opportunities from the greater use of generic medications: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2016;164:41-49.
11. Desai RJ, Sarpatwari A, Dejene S, et al. Diff
12. Hansen RA, Qian J, Berg R, et al. Comparación de las tasas de devolución de genéricos a marcas entre medicamentos genéricos y genéricos autorizados. Pharmacotherapy. 2017;37(4):429-437.
13. Desai RJ, Sarpatwari A, Dejene S, et al. Eficacia comparativa del uso de medicamentos genéricos y de marca: un estudio de base de datos de las reclamaciones del seguro de salud de los Estados Unidos. PLoS Med. 2019;16(3):e1002763.
14. FDA. Qué saber y hacer sobre posibles nitrosaminas en su medicación. www.fda.gov/consumers/consumer-updates/what-know-and-do-about-possible-nitrosamines-your-medication. Consultado el 13 de mayo de 2020.
15. Straka RJ, Keohane DJ, Liu LZ. Potencial impacto clínico y económico del cambio de medicamentos de marca por genéricos. Am J Ther. 2017;24(3):e278-e289.
16. Ngo SNT, Stupans I, McKinnon RA. Sustitución de genéricos en el tratamiento de la epilepsia: actitudes y percepciones de los pacientes. Epilepsy Behav. 2013;26:64-66.
17. Greb E. Un estudio revela las preocupaciones sobre el cambio de medicamentos antiepilépticos de marca a genéricos. Neurology Rev. 2014;22(3):6.
El contenido de este artículo es sólo para fines informativos. El contenido no pretende ser un sustituto del asesoramiento profesional. La confianza en cualquier información proporcionada en este artículo es únicamente bajo su propio riesgo.