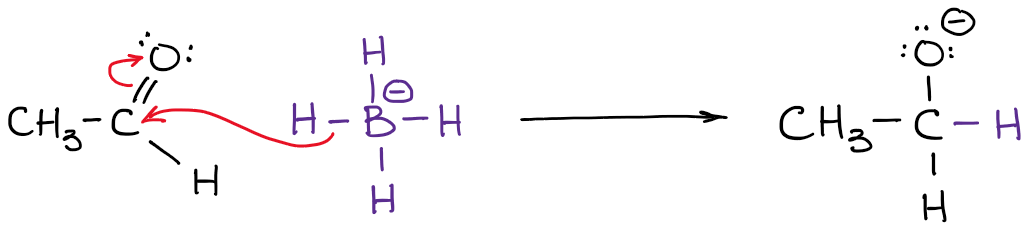Las cargas formales en química orgánica es, quizás, uno de los dispositivos de contabilidad más fundamentales que a menudo es mal entendido o descuidado por los estudiantes.
¿Por qué las cargas formales son importantes en la química orgánica?
Conocer las cargas formales puede ayudarnos a entender los patrones de reactividad en las reacciones, encontrar los centros reactivos, y dar sentido al flujo de electrones en los mecanismos. Por ejemplo, las especies con carga negativa tienden a ser las fuentes de densidad de electrones en las reacciones, mientras que las especies con carga positiva aceptan esos electrones.
Aquí hay un par de ejemplos de moléculas con cargas formales:
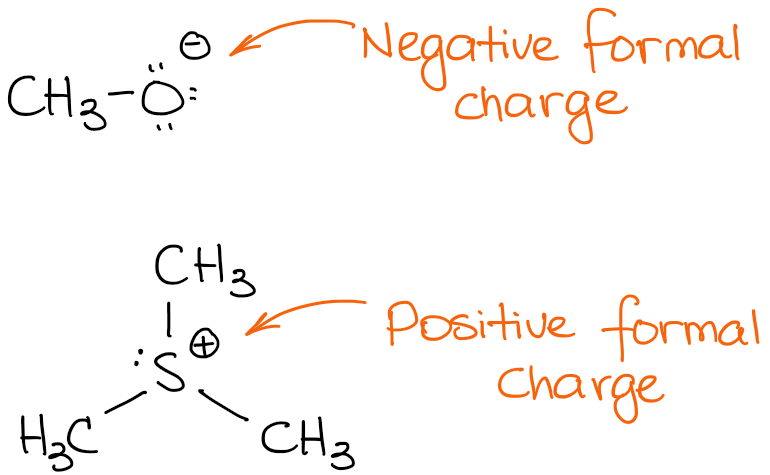
La especie superior tiene carga negativa. A estas especies las llamamos aniones. Al tener una carga negativa, significa que tiene un exceso de densidad de electrones. Por lo tanto, es probable que sea la fuente de esos electrones en una reacción. Las fuentes de densidad de electrones en una reacción orgánica actúan como nucleófilos o bases.
La segunda especie tiene una carga positiva, por lo que es una especie catiónica. En una reacción, una especie catiónica será un aceptor de electrones actuando como un ácido (ya sea de Brønsted o de Lewis) o como un electrófilo.
¡Es importante tener en cuenta que una carga formal no es lo mismo que una carga real! Hablaré de ello un poco más adelante en este post.
Cómo calcular una carga formal
La forma «oficial» es restar 1/2 electrones enlazantes y electrones no enlazantes a los posibles electrones de valencia que puede tener un átomo. En otras palabras:

¿Qué son todos esos términos?
Los electrones de enlace son los que forman los enlaces. Cada enlace contiene 2 electrones. Por tanto, 1/2 de los electrones enlazantes es igual al número de enlaces que tiene el átomo.
Los electrones no enlazantes son aquellos que no participan en ningún enlace. En otras palabras, los electrones no enlazantes son los electrones sobrantes (generalmente pares de electrones) en un átomo. Usando los ejemplos de arriba tenemos:

Las definiciones y el método «oficial» se ve un poco feo. Como químico profesional puedo hablar todo el día de las «reglas oficiales» y de los «nombres propios» y aburrirte hasta la saciedad. En su lugar, prefiero que utilices un sencillo «truco» que siempre funciona y que, en esencia, es lo mismo. El truco es:
Carga formal = Electrones de valencia – Palos – Puntos
El número de electrones de valencia es igual al grupo (columna) del elemento en la tabla periódica. Así, el carbono tiene 4, el oxígeno 6 y el hidrógeno 1 electrones de valencia. Los enlaces y los electrones sobrantes se indicarán (o se podrán encontrar fácilmente) en la estructura de Lewis de la molécula. Así que, siempre que tengas a mano una estructura de Lewis completa y una tabla periódica, puedes encontrar rápidamente la carga formal de cualquier átomo de una molécula.
La diferencia entre la carga formal y la carga real
Ahora, he mencionado antes que hay una diferencia entre la carga formal y la carga real. La carga formal es una herramienta de contabilidad que es importante para ayudarnos a seguir el flujo de electrones en la reacción.
La carga real, sin embargo, es la densidad real de electrones que está presente en el átomo. Por ejemplo, echemos un vistazo al anión borohidruro:

La electronegatividad del boro es 2.0 mientras que la electronegatividad del hidrógeno es de 2,2. Por lo tanto, el hidrógeno es más electronegativo (no por mucho pero aún así) y polarizará el enlace. Esto significa que el hidrógeno realmente «tira» de la densidad de electrones hacia sí mismo. Así:
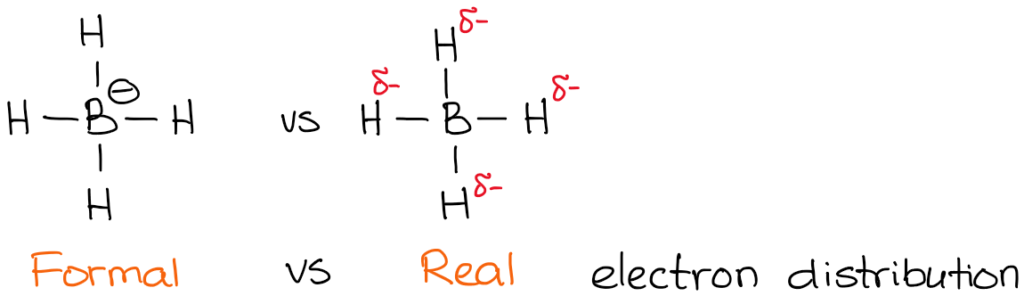
Aunque las cargas formales son una mera «formalidad»,» son muy importantes para la comprensión de los mecanismos de las reacciones. Por lo tanto, debes asegurarte de dominar la habilidad de encontrar rápidamente la carga formal.
También se nota que he indicado mis densidades reales de electrones con el símbolo delta-menos (𝛿-). Eso denota que sólo tengo una carga parcial negativa en cada uno de los hidrógenos. ¿Cuánto de esa carga parcial tenemos en ellos? Bueno, podríamos calcularlo usando cálculos químicos cuánticos de lujo, pero eso es totalmente innecesario para los propósitos de un curso típico de química orgánica. Lo que es más importante, es darse cuenta de que el boro no está realmente cargado negativamente en esta molécula. Así que, cuando escribamos una reacción con un anión borohidruro, ¡no mostraremos electrones procedentes del boro!